
Alex William
Marin Cherrez a; Marjorie Jacqueline Ramírez Ortiz b; María Belén
Zhindón
Astudillo c;
Javier Fabricio Valdez Zambrano d
Factores de riesgo, Diagnóstico y Tratamiento de la enfermedad de
Legg-Calvé-
Perthes
Risk factors, diagnosis and treatment of Legg-Calvé-Perthes disease
Revista Científica
Mundo de la Investigación
y el Conocimiento.
Vol. 3 núm.3. Esp., noviembre,
ISSN: 2588-073X, 2019, pp. 395-420
DOI: 10.26820/recimundo/3.(3.Esp).noviembre.2019.394-420
URL: http://recimundo.com/index.php/es/article/view/604
Código UNESCO: 3205 Medicina Interna
Tipo de Investigación: Artículo
de Revisión
© RECIMUNDO; Editorial
Saberes
del Conocimiento,
2019
Recibido: 15/09/2019 Aceptado: 23/10/2019 Publicado: 30/11/2019
Correspondencia: alexmuchinch@gmail.com
a. Médico; Investigador Independiente; Guayaquil, Ecuador;
alexmuchinch@gmail.com
b. Magister en Seguridad, Higiene Industrial y Salud Ocupacional; Médico; Investigadora Independiente; Guayaquil, Ecuador;
elloreal_22@hotmail.com
c. Médico; Investigadora
Independiente; Guayaquil, Ecuador;
belenzhindon11@hotmail.com d. Médico; Investigador Independiente; Guayaquil, Ecuador;
fa_vaza@hotmail.com
RESUMEN
La enfermedad de Legg-Calvé-Perthes (ELCP/LCPD, por sus siglas en inglés) básicamente se encuentra relacionada a un problema en
la cabeza del
fémur, debido
a la falta de aporte
sanguíneo. Históricamente considerada una osteocondrosis, ahora
se la conoce como necrosis avascular idiopática de la cabeza femoral en la población pediátrica [NAV]. Etiológicamente, esta
complicación aún
no
ha
sido
precisada, por lo que es
considerada muy extraña. Su
incidencia es destacadamente variable entre
países, inclusive ha sido así dentro de
un mismo país
en
función del área geográfica. Lo expuesto ha
sido el fundamente
del
interés por
desarrollar
este tema, y en razón de ello se dispuso el desarrollo de una investigación documental en base a una
metodología de revisión enfocada en referir los factores de riesgo, diagnóstico y tratamiento de
la ELCP. Los resultados obtenidos
tras la consulta
en distintas bases de
datos arrojaron suficiente
información vigente que sirvió no solo para
alcanzar el objetivo preestablecido, sino además para
definir otros aspectos igualmente relevantes para la comprensión de este tema, tales como sus
definiciones, síntomas y
etiología relacionada. En definitiva, se logró concluir que, la ELCP aún se concibe como una
patología de
investigación constante, sobre todo por determinar
su etiología definitivamente, entre los factores de riesgo destacan la edad comprendida entre 2 y
8 años, el
sexo masculino, la
raza blanca, anomalías genéticas, entre
otras. El diagnóstico gravita
sobre la sospecha sintomatológica, que luego pudiera ser constatado mediante radiografía convencional,
en
otros casos con gammagrafía y/o ecografía, mientras que en las primeras etapas es mejor la IRM. Entre sus
tratamientos ha figurado el consenso generalizado entre los
especialistas ortopédicos, quienes defienden la idea
de mantener la cabeza femoral dentro del acetábulo
como medida estratégica para evitar, entre otras cosas, presiones deformantes sobre
la epífisis femoral
en
la fase de reparación o de plasticidad biológica, la
osteoartritis de la cadera con su indeseable
cortejo clínico; y promover su esfericidad, asegurar que se mantenga un buen rango de movimiento
en la cadera y minimizar
los cambios artrósicos secundarios
a esta
patología.
Palabras Claves: Irrigación de
la epífisis capital femoral; Osteocondrosis; Necrosis avascular idiopática; Epífisis femoral; Alteraciones isquémicas.
ABSTRACT
Legg-Calvé-Perthes disease (ELCP / LCPD) seems to be
a problem in the
head of the femur,
due to the lack of blood report. Historically it had an osteochondrosis, now it is known as idiopathic
avascular
necrosis of the
femoral head in the pediatric
population [NAV]. Etiologically, this complication has not yet been precise, so it is very
very
strange. Its incidence is remarkably
variable between countries, including it has been so within the same country depending
on the geographical area. The above
has
been the basis of interest in developing this issue, and because
of that, the development of a documentary
investigation based on a review methodology focused
on referring
the risk factors, diagnosis and treatment of the ELCP. The results obtained after consultation in different databases yielded sufficient current information
that served not only to achieve the pre-established objective, but also to define other aspects equally relevant for the understanding
of this topic, stories such as limitations, symptoms and related etiology. In
conclusion, it is concluded that, the ELCP is still conceived as a constant research pathology, especially
for determining
its etiology
definitively, among the risk factors including the age between 2 and 8 years, the male sex, the white race, genetic abnormalities, among
others. The diagnosis gravitates on symptomatic suspicion, which could then be verified by
conventional radiography, in other cases with scintigraphy and / or ultrasound, while MRI is better in the early stages. Among its treatments has been the general consensus among
orthopedic specialists, who defend the idea of keeping the femoral head inside the acetabulum
as a strategic measure to avoid, among
other
things, deforming pressures on the femoral epiphysis during the repair or
biological plasticity
phase. , osteoarthritis of the hip with its undesirable clinical courtship; and promote its sphericity, ensure
that a good range of movement in the hip is maintained and minimize the
arthritic changes
secondary to
this pathology.
Keywords: Femoral capital epiphysis irrigation; Osteochondrosis; Idiopathic avascular necrosis; Femoral epiphysis; Ischemic alterations.
Introducción.
Según Padilla, Maya, Bolaños, & Guerrero (2019) la enfermedad de Legg-Calvé-Perthes (ELCP/LCPD, por sus siglas en inglés) primeramente fue presentada en 1910 por Arthur Legg,
en
Boston, Estados Unidos de América. De manera
indirecta, ese mismo año en Francia, Jacques
Calvé proveyó destacados aportes al estudio de Legg y finalmente Georg Perthes hizo lo propio en
1924.
Es un padecimiento ortopédico que afecta el desarrollo de la cadera
en
los niños, debido a que la irrigación de la epífisis capital femoral presenta alteraciones isquémicas, de
origen aún desconocido,
que
culminan en
necrosis. Es una
enfermedad rara con
una incidencia anual variable (una
de cada 250 000 personas en Hong Kong; una de
cada
18 000 en Reino Unido). La
ELCP es
hasta cinco veces
más frecuente en
niños que en niñas. (p. 36).
La
incidencia de la enfermedad de Perthes varía notablemente entre países e incluso
dentro del mismo país en función del área geográfica. Es más frecuente en blancos que en
asiáticos o negros.
Afecta más a hombres que a mujeres en una
proporción de 5/1. En un 15%
de los casos la afectación es bilateral y asimétrica. (Mínguez & Salom, 2015).
Particularmente, Rampal, Clément, & Solla (2017) dicen que esta patología constituye la necrosis de la cabeza femoral avascular idiopática en la población pediátrica [NAV] y afligiendo
a niños de entre 2 a 10 años de edad. De la misma manera
alegan que no es bien conocida la etiología
precisa
de
esta complicación.
La epífisis femoral afectada sufre diversos
grados de necrosis auto
limitada,
lo que conduce a un amplio espectro de patología y evolución, desde formas leves sin secuelas hasta deformidades graves con un rango de movimiento limitado y osteoartritis temprana de la articulación de la cadera. Clínicamente, el LCPD generalmente se presenta con cojera y dolor localizado en el muslo y / o la rodilla, que ocurre después de una actividad física sostenida en un niño sano y
/ o déficits en la abducción y rotación interna, y marcha de Trendelenburg en etapas avanzadas. La
radiografía
simple es el procedimiento de diagnóstico adicional más actual para evaluar la etapa de la enfermedad, la contención de la cabeza femoral en el acetábulo y el grado
de afectación del capital. Las indicaciones para el tratamiento dependen principalmente del pronóstico sobre la esfericidad de la cabeza femoral y la congruencia de la cadera al final del crecimiento. (p. 74).
El objeto de la presente revisión estará
enfocado en referir
cuales
son los factores de
riesgo, los criterios diagnósticos
y de tratamiento asociados a la ELCP, siendo
necesario para
ello,
proceder previamente a definir algunas de sus acepciones aún
vigentes, así
como también su sintomatología y etiología asociada.
Materiales
y Métodos.
Las herramientas y
materiales de trabajo que se utilizaron en el desarrollo de este trabajo investigativo fueron: computadores personales con
conexión
a
internet
y
un
cúmulo
de
contenidos cientificoacadémicos
variado, con los
que se
persiguió el objetivo
aportar información de precisa y vigente respecto a los Factores de riesgo, Diagnóstico y
Tratamiento de la enfermedad de Legg-Calvé-Perthes. Para ello se determinó efectuar un
trabajo investigativo de diseño
documental, de tipo no experimental, a nivel descriptivo,
de corte transeccional y bajo una metodología de revisión.
A fines del mencionado
objetivo, básicamente
se adelantó una búsqueda de literatura científico-académica reciente, usando como expresiones claves "Legg-Calvé-Perthes", "necrosis
avascular" y "osteonecrosis de la cabeza femoral
en
niños", tanto en español como en inglés, en
diversas bases de datos, tales como: NCBI, BVS, Intramed, MEDLINEPLUS, SciELO, BASE,
entre otras.
El tipo de material que se supuso conseguir fue el relativo a: artículos
científicos,
guías
clínicas, e-books, consensos,
protocolos,
tesis de posgrado
y
doctorado,
ensayos clínicos, noticias científicas, boletines y/o folletos de organismos nacionales e internacionales, públicos o
privadas con reconocimiento en el área de la salud, medicina, científica y académica; así como
también otros tipos de documentos e informaciones considerados (a criterio
del
equipo) como de
utilidad científico-académica
por el valor de la evidencia contenida en los mismo, que,
primordialmente, estuvieran accesibles
de manera completa y gratuita, y además, que
hubiesen sido publicados en los últimos 10 años (incluyendo el corriente) preferiblemente, lo que significa
que, igualmente se consideró hacer algunas excepciones.
En consenso, se desestimó todo aquel material que, en su contenido,
se detectó con sesgada evidencia o de un valor de escaso nivel, así como también aquella considerada de poco
interés científico-académico, entre esas: cartas al editor, resúmenes, monografías, anotaciones e
en
algunos casos,
inclusive, estudios de cohorte, reportes de casos y controles, series y otros tipos de textos.
Entre las distintas bases de datos utilizadas, la tendencia
de los resultados obtenidos
estribó entre 16 y 197 fuentes bibliográficas de índole distinta, sin embargo, fue
considerablemente mayor en
los
casos de
otras
pesquisas
complementarias efectuadas sin criterios mayores, que respondían más al interés por hallar toda aquella información
consensuadamente entendida como de relevancia para el desarrollo general de la temática planteada.
Estos hallazgos, en conjunto, demostraron que este tema se encuentra lo ampliamente documentado, sin
embargo, la necesidad de depurar dichos resultados se hizo evidentemente
ineludible, razón por la que, ordenada y progresivamente se fueron aplicando ciertos filtros que,
fundamentalmente se encontraban disponibles para su uso en cada base de datos consultada, y que respondían
en
términos generales a criterios tales como: nivel de acceso al recurso, tipo de
literatura, idioma, correlación y/o relevancia temática, fecha (o rango) publicación,
especialidad (área) temática, entre otros.
Posterior a los procesos antes
descritos, es cuando el equipo
procedió con la
aplicación
de técnicas de estudio, tales como: lectura crítica y análisis de datos, interpretación y discusión
de todos los documentos definitivamente escogidos, determinados como evidencia para este trabajo
investigativo, sumario que sucesiva y definitivamente resultó en la fundamentación de las ideas
referidas, que por cierto en todo momento
se hizo bajo completo acuerdo.
Finalmente, se aclara que fue a través del mismo consenso grupal que se incluyó y eexcluyó, no solamente cada una de las citas y referencias expuestas, sino también las opiniones
divergentes.
.
Resultados.
La
enfermedad de Legg-Calvé-Perthes [ELCP / LCPD, por sus siglas en inglés] es relacionada
a un
problema en la cabeza del fémur, que en sí vendría siendo la parte esférica del hueso que encaja en la cavidad de la cadera (Figura 1),
debido a la falta de aporte sanguíneo.
Figura 1. Representación de la Cabeza del Fémur normal,
con daño y otras
partes.
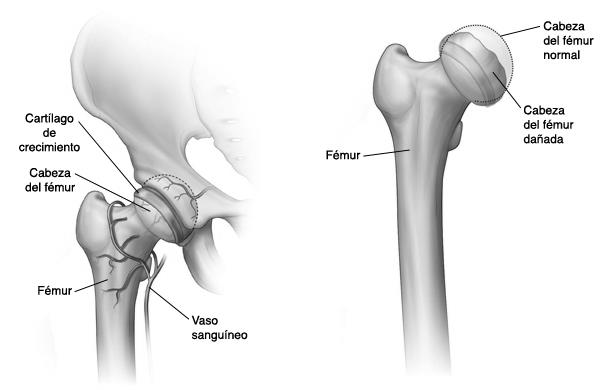
Fuente: (Krames StayWell, 2018)
 En la obra de Wiig (2009) se deja claro que la ELCP es un término
que se usa para
describir la necrosis avascular uni lateral o
bilateral (NAV)
de
la cabeza femoral en los niños.
En la obra de Wiig (2009) se deja claro que la ELCP es un término
que se usa para
describir la necrosis avascular uni lateral o
bilateral (NAV)
de
la cabeza femoral en los niños.
La incidencia anual varía considerablemente, desde 1/250.000 en Hong Kong y 1/18.000
en
Reino Unido, a 1/3.500 por año en las Islas Feroe. La LCPD afecta a niños de edad comprendida
entre los 2 y los 12 años, pero es más prevalente en niños de entre 5 y 6 años y más común en varones.
Padilla, Maya, Bolaños, & Guerrero (2019) en su estudio alegan que esta se define por:
[…] la necrosis
en el tejido óseo, cartílago articular con proliferación de condrocitos en capas superficiales y tejido muerto
en
la capa profunda con posible fractura subcondral del hueso contiguo y rotura de la placa de crecimiento,
lo cual progresa a resorción ósea y finalmente a una reosificación. Todo esto se ve reflejado en
una radiografía, en la que se presenta la cabeza femoral en forma de hongo con
acortamiento y engrosamiento del cuello; remodelación del acetábulo, inclinado
con
eje acortado; y rarefacción metafisiaria. (p.
36).
La opinión de Pavone (2019) es que
esta es una complicada enfermedad de
la población pediátrica que afecta
la epífisis de la cabeza femoral.
Así mismo dejan ver que:
Históricamente considerada una osteocondrosis, ahora se
la conoce como necrosis
avascular
idiopática de la
cabeza femoral en la
población pediátrica. Entre
su prevalencia no hay acuerdo general. Se establece entre 0,4 / 100000
a 29,0 / 100000 niños <15 años de edad con un pico de incidencia en niños de 4 años a 8 años y una relación hombre / mujer de 5:1. Un estudio epidemiológico de alto perfil realizado en 2017 con la participación de 2,1 millones de
personas intentaron informar una prevalencia más precisa de esta enfermedad. Se encontró una
prevalencia general de 9.3 por 100000 sujetos. La relación hombre / mujer fue de 3.1: 1. Aunque el estudio se realizó en Suecia desde 1973 hasta 1993, es una de las fuentes de evidencia más actualizadas de la epidemiología de LCPD
Síntomas
Los síntomas iniciales
son generalmente: cojera, dolor en
la cadera, muslo
o rodilla y movilidad de cadera reducida. Más tarde, durante el curso de la enfermedad, puede observarse
una discrepancia de la longitud de la pierna, así como una atrofia muscular alrededor de la cadera. La fase activa de la enfermedad puede durar varios años y
se caracteriza por la
necrotización parcial o total de la cabeza femoral y su progresiva deformación. Esta fase está
seguida por la formación de hueso nuevo (re-osificación)
en la epífisis y la eventual curación. La
deformación final puede variar
de una configuración casi normal de la
articulación, a una deformación extensa con aplanamiento y
subluxación graves de la cabeza femoral, alargamiento del cuello femoral y deformación y displasia del acetábulo, que a su vez puede conducir a una osteoartritis
de aparición temprana. (Wiig,
2009).
De acuerdo con Hernández, Romero, Osorto, & Madrid (2014), la sintomatología y lo
que se detecta tras la exploración física será muy variada en relación a la etapa en que se ubique
esta complicación, que
de conformidad a
su avance
en
el tiempo, se
divide en cuatro fases que son:
I. Inicial
duración
promedio de 6 meses (1-14 meses)
II. Fragmentación
de 8 meses (2-35
meses)
III. Reosificación
o cicatrización de 51 meses (2-12 meses)
IV. Residual
o remodelación continua hasta
la madurez esquelética.
En las primeras fases de la enfermedad la presentación más frecuente suele ser la de
un niño con cojera o con dolor
progresivo en la ingle, el muslo o la rodilla. En la exploración
física encontraremos una hipotrofia o atrofia del muslo, los gemelos y
la nalga del miembro inferior. (p. 18-19).
En el mismo orden de ideas, el personal del Hospital Infantil de
Stanford
de Estados Unidos de América describe que en la fase I (inicial). se manifiesta la inflamación, rigidez y
dolor en las articulaciones de la cadera. En algunas partes del hueso se genera la necrosis del
tejido óseo. Radiológicamente, la cabeza del fémur se ve
menos redondeada. Toda
esta esta fase
puede durar desde unos meses hasta un año. En la fase II (fragmentación), que en tiempo puede
ocurrir desde uno hasta tres años, las células óseas muertas serán eliminadas por el cuerpo y
las reemplazará por células óseas nuevas y más sanas. La forma redondeada de cabeza femoral comenzará nuevamente a generarse mientras que se mantiene la irritación al igual que dolor en
las articulaciones. La fase III (osificación) que igualmente podría
durar de uno a tres años, se
caracterizará por continuación de la confección redondeada la cabeza
del
fémur, así como de nuevo tejido óseo. Para fase IV (curación), las nuevas células óseas serán reemplazadas por las
células normales, pudiendo este proceso manifestarse durante varios años hasta completar el proceso de curación. (Lucile Packard Children’s Hospital Stanford, 2019).
En este nivel se vuelve importante mencionar el aporte de Vargas &
Martínez (2012) debido a que refiere
que
fue (Herring, 1992) quien creó "una clasificación basada en los cambios radiológicos del segmento lateral de la cabeza
femoral en fase
de fragmentación" (Figura
2.) determinando entonces:
[…] 3 grupos [A, B y C] según la
altura de dicho segmento, encontrando una correlación clara
con
el pronóstico de la enfermedad ya que, a mayor altura, mayor
protección contra el derrumbamiento, y cuando correlacionamos
los hallazgos radiológicos con la
edad de
aparición de la enfermedad el nivel de predicción es mejor. (p. 169).
Los mismos autores parten del
hecho de que,
según
la mencionada clasificación,
lo que se considera «Normal»
es
la "división funcional de la cabeza del fémur en pilares lateral, central y medial". Por
lo tanto, describen que:
Grupo A: La altura del pilar lateral es la normal. Puede haber radiolucidez en
pilares central y medial, pero sin pérdida de altura
del pilar lateral. Buen pronóstico.
Grupo B: Pérdida de altura del pilar lateral pero menor del 50% de su altura normal.
El segmento central
puede estar más hundido.
Grupo C: El colapso del pilar lateral es superior al 50% de su altura normal. Los pilares central y medial pueden haber perdido su altura normal, pero en menor grado que el pilar lateral. Mal pronóstico. […] Sobre esta clasificación algunos autores han creído conveniente agregar un cuarto grupo denominado «grupo B/C» para casos limítrofes en los que el pilar lateral conserva la altura del 50%, pero el segmento remanente tiene muchas irregularidades radiográficas1,6. La clasificación del pilar lateral de Herring tiene un mayor valor pronóstico y menor variabilidad interobservador que la clasificación de Catterall2,8, por lo que hoy día es la clasificación más utilizada. (Vargas & Martínez, 2012, p. 169 - 170).
Figura
2. Clasificación
de
Herring (Área necrótica en
la sombra más oscura)

Etiología
La etiología de
la LCPD permanece
desconocida. En general, se cree
que la deformación
puede estar causada por uno o más infartos de la cabeza femoral, secundarios a la interrupción
del
aporte vascular. Sin embargo, también existen otras teorías sobre
la causa de
la interrupción. (Wiig, 2009).
Este aspecto ha sido destacadamente
investigado por Pavone
et al.
(2019) ya
que, respecto a la etiología de la LCPD ha indicado
que aún
se desconoce fundamentalmente.
Los tratadistas
explican
que
ello
es debido
a
la
variada
prevalencia indicada en
importantes estudios, lo que
entonces ha abierto el debate en cuanto a la
evaluación de
los "posibles factores ambientales y sociales involucrados en la etiología de la enfermedad". En base
a ello, refieren, tres estudios evidenciaron (aún no definitivamente) una posible relación entre
la reducción de la ocurrencia y
los cambios en el estilo de vida en los últimos años, la exposición a
factores de riesgo ambientales como el tabaquismo, la osificación hipofisaria
tardía, el bajo peso
al nacer, la privación infantil y la obesidad.
Continúan refiriendo que, otros estudios demostraron más
fehacientemente la relación entre la incidencia
de LCPD
en niños y el papel
de la privación social y económica.
Esto se propuso como una
posible consecuencia de
dos factores: bajo peso al
nacer y hábitos de fumar. Además, el tabaquismo materno se asocia con un bajo peso al nacer. Por
lo tanto, el bajo peso al nacer a menudo podría asociarse falsamente
con LCPD debido al hábito de fumar típicamente
presente en estas familias, que es la causa
más probable de la mayor incidencia
de LCPD. Por estas razones, el papel del bajo peso
al
nacer carece de evidencia sólida, y el hábito de fumar, que es más común en las
familias desfavorecidas socioeconómicamente, puede
desempeñar un papel más
importante en la etiopatogenia
de la LCPD. Esto fue confirmado por estudios que investigaron la asociación
entre fumar y LCPD, que informaron
un
aumento significativo del riesgo en fumadores y familiares expuestos al humo. El mecanismo propuesto es el daño dependiente del humo del endotelio de los vasos, que en última
instancia podría conducir a un infarto
hipofisario. (p.159).
Así mismo, los autores han indicado que reciente evidencia señala a la obesidad como un
factor
de
riesgo importante.
La leptina es una
hormona que se expresa en el tejido adiposo y, en niveles más
bajos, en el epitelio gástrico y la placenta asociados con la obesidad y
el
metabolismo óseo. Se ha informado que tanto
la leptina como la obesidad se asocian positivamente
con
la gravedad de la LCPD. La mayoría
de los humanos obesos tienen concentraciones de
leptina en plasma muy altas, lo que sugiere que son resistentes a sus efectos anoréxicos y metabólicos. En base a estos hallazgos, Bartell et al. 2011 realizó un
estudio que incluyó la administración intracerebroventricular y subcutánea de leptina en ratones ob / ob con deficiencia de leptina, investigando su efecto sobre los tejidos óseos
y musculares. En ambos experimentos, la leptina tuvo un papel clave en la disminución del peso corporal, la ingesta de alimentos y la grasa corporal y en el aumento de la masa muscular, la densidad mineral ósea, el contenido mineral óseo, el área ósea, el número
de adipocitos de médula y la tasa de aposición mineral. Por lo tanto, la administración de leptina parecía ser realmente efectiva en el metabolismo óseo de pacientes obesos. Siguiendo esta justificación, Zhou et al. 2015 probó estos efectos en un modelo de rata
obesa LCPD. Seis semanas después de
la cirugía
indujo necrosis avascular de la cabeza femoral, se
realizaron
evaluaciones
radiológicas e histomorfométricas. Las radiografías
mostraron una mejor preservación de la arquitectura de la cabeza femoral en el grupo tratado con leptina. La histología y la inmunohistoquímica revelaron que el grupo de leptina había aumentado significativamente la proliferación osteoblástica y la vascularización en las cabezas femorales infartadas en comparación con los grupos
de control. El mecanismo propuesto está relacionado tanto con una acción directa de la leptina sobre el metabolismo óseo como con una acción indirecta a través de la
regulación positiva de VEGF. En particular, la leptina actúa fisiológicamente a través de
las vías MAPK / ERK 1/2 y PI-3K / AKT1 y una serie de factores de transcripción como HIF-1α. La evidencia emergente respalda cómo la leptina y la obesidad pueden desempeñar
un papel en la etiopatogenia de LCPD. Recomendamos encarecidamente
realizar más estudios sobre la leptina y la obesidad, asociados con sus efectos del
metabolismo óseo, en pacientes con LCPD. Estos estudios deben realizarse como una opción terapéutica y como un posible actor en la etiología de la enfermedad. La
diferencia en la incidencia entre sujetos masculinos y femeninos inicialmente se pensó que dependía de la etiopatogenia
diferente de la enfermedad. En particular, los estudios
pioneros sobre estas diferencias informaron una presentación y
un pronóstico más severos en pacientes femeninos que en sujetos
masculinos. Sin embargo, estudios epidemiológicos recientes de alto perfil no informaron diferencias significativas en la
presentación clínica, el resultado y el pronóstico entre niños y niñas. Por lo tanto, la relación LCPD hombre / mujer parece no estar asociada con diferentes presentaciones clínicas y no debe ser parte
del algoritmo de tratamiento clínico. (p. 159).
En definitiva, estos expertos refieren que entre otras fortalezas de su estudio destacan el hecho de: haber efectuado una
exhaustiva
búsqueda por medio de la cual pudieron identificar todos
los estudios importantes sobre asociación genética, la comorbilidad más frecuente y la posible hipótesis etiológica. "Por lo tanto, la evaluación del riesgo de sesgo mostró un riesgo general
moderado que podría influir en
nuestro análisis."
De
la misma manera reconocen
que:
La literatura disponible sobre la etiología de LCPD presenta limitaciones
importantes en
términos
de
gran heterogeneidad y falta
de estudios de alto perfil.
Aunque muchos estudios se centraron en los antecedentes genéticos, biomecánicos y
radiológicos de la enfermedad,
no
hay
consenso sobre uno o múltiples actores principales de la etiopatogenia. Si bien la obesidad, la exposición al tabaquismo y la
privación infantil parecen estar asociadas con la etiología del LCPD, se
necesitan más estudios para comprender la génesis compleja y multifactorial de la necrosis avascular que
caracteriza la
enfermedad.
(p. 160).
Factores de Riesgo
- La edad.
Aunque la enfermedad de Legg-Calvé-Perthes puede afectar a los niños de
casi cualquier edad,
es
más frecuente
que comience entre las edades de 4 y 8
años.
- El sexo del niño. Legg-Calvé-Perthes es cinco veces más frecuente entre los niños que
entre las niñas.
- Raza. Los
niños de raza blanca son más
propensos a manifestar esta alteración
que aquellos de raza negra o afroamericana.
- Mutaciones genéticas. En una pequeña cantidad de casos, la enfermedad de Legg-
Calvé-Perthes
parece estar
relacionada con mutaciones
en ciertos genes. (Mayo
Clinic, 2018)
Se han sugerido otros factores implicados: retraso en la maduración esquelética, déficit del crecimiento y crecimiento desproporcionado, estatura baja, bajo peso al nacer, privación social y económica y traumatismo, así como una asociación con anomalías
congénitas.
También se ha sugerido que
los trastornos
del sistema de coagulación pueden
causar trombofilia y/o hipofibrinolisis y conducir a la oclusión trombótica venosa, con posterior NAV
(necrosis
avascular) de la cabeza femoral en los niños. (Wiig, 2009)
Diagnóstico
El diagnóstico se realiza por radiografía convencional con proyecciones
frontal y lateral.
La
gammagrafía y la ecografía pueden ser útiles en algunos casos y la IRM [imagen por resonancia magnética] puede ser
útil
en las primeras etapas de la enfermedad para distinguir la LCPD de otros trastornos de
la cadera. El diagnóstico diferencial incluye
la displasia de Meyers,
la displasia epifisiaria múltiple y la displasia
espondiloepifisiaria. (Wiig,
2009)
Pessler (2017) particularmente afirma
que:
El diagnóstico de la enfermedad de Legg-Calvé-Perthes se sospecha por los síntomas. Por lo general, se obtienen rayos X y, si se necesita, se realiza una RM para confirmar el diagnóstico y el alcance de la lesión. Al principio, las radiografías pueden
no ser diagnósticas, porque
son normales o muestran mínimo aplanamiento. Las radiografías posteriores pueden mostrar
fragmentación de
la cabeza femoral, que
contiene zonas radiolúcidas y de esclerosis. En los casos bilaterales o familiares, se impone un estudio radiográfico del esqueleto para descartar trastornos esqueléticos hereditarios, en particular la displasia epifisaria múltiple, porque el pronóstico
y el tratamiento
óptimo son diferentes. También deben descartarse
el
hipotiroidismo, la anemia drepanocítica y los traumatismos.
Tratamiento
Para
Wiig (2009) el
objetivo principal
es
el de contener la cabeza femoral en
el acetábulo,
usando un aparato ortopédico o
por medio de intervenciones quirúrgicas (osteotomía femoral o pélvica).
Un
estudio reciente sugiere
que la osteotomía femoral da resultados
significativamente mejores que el tratamiento
con aparatos ortopédicos
(concretamente,
la órtesis de abducción de tipo «Scottish Rite » (Wiig,
2009).
Por su parte, Mínguez & Salom (2015) aseguran que aún es debatido el tratamiento
idóneo para la enfermedad de Legg–Calvé–Perthes, sin embargo, en la
comunidad ortopédica se ha dado un consenso generalizado que respalda la idea de
"la contención de la cabeza femoral como medida
para promover su esfericidad y minimizar los cambios artrósicos
secundarios a esta
patología. Esta contención
puede obtenerse
por métodos conservadores o
quirúrgicos". (Mínguez & Salom, 2015).
En
esto concuerdan Hernández, Romero, Osorto, & Madrid (2014), ya que
respecto a
la contención de la epífisis femoral dentro del acetábulo explican que: "[…] tiene
como finalidad
evitar presiones deformantes sobre la
epífisis femoral en la fase de reparación o de plasticidad biológica,
para prevenir
la
osteoartritis de la
cadera con su indeseable cortejo
clínico." (p. 19).
Es necesario hacer una
distinción referente a
lo antes
dicho respecto a la contención de la
cabeza femoral en el acetábulo, por ello es oportuno referir la obra
de Hunt et al. (2012) quienes describen
que
dichos métodos (invasivos o no)
están referidos
a aquellos:
I. No quirúrgicos: por
tratarse de
diversos aparatos entre los que destacan "el de
Toronto, el de Birmingham, el Newington, el de Tachdjian y el de Atlanta"
que tras su uso
han
resultado en demostrar
distintos grados de
éxito. No obstante,
aclaran que en la actualidad "estos métodos de tratamiento
están en desuso, ya que varios estudios han demostrado que no alteran favorablemente
la evolución natural de la enfermedad" aunado a
esto se manifiesta la incomodidad
de su utilización, su necesario
uso prolongado, la dificultad para determinar el inicio y fin de su implementación, y
el
marcado rechazo
manifestado tanto por el paciente
como por sus familiares en cuanto al uso de
este tipo de
aparatos.
II. Quirúrgicos: Mayormente indicados para aquellos casos de pacientes con mayor grado de afección en las caderas y pacientes con edad superior a los 6 años, siendo necesario en ambos efectuar un manejo adecuado de los efectos asociados. La Osteotomía femoral proximal y la Osteotomía de Salter vendrían siendo los dos procedimientos más frecuentemente ejecutados. El primero de ellos definido como la osteotomía varizante de la porción proximal del fémur, se refiere a centrar la cabeza femoral en la profundidad del acetábulo mientras mantiene el miembro alineado en posición de carga; mientras que el segundo:
[…] consiste
en
efectuar un corte horizontal del iliaco, para reorientar
el fragmento distal de la hemipelvis, trasladando el cótilo hacia abajo (aducción) y
delante (extensión), usando como pivote de rotación
a la sínfisis púbica.
El efecto que se
obtiene es cubrir la cabeza femoral por arriba, por lateral (aproximadamente 15°) y por
anterior (aproximadamente
25°). (p. 11).
Estos igualmente
aclaran que
se dan casos en los que
la combinación de
las referidas
osteotomías se vuelve necesaria para obtener "una mayor cobertura de la cabeza femoral", y
ello
comúnmente ocurre en pacientes de más de 9 años de edad, con subluxación lateral de la
cabeza
femoral. A la par refieren que existen otros
procedimientos que se pudieran llevar a cabo, tales
como: Artroplastía tipo Shelf:
formalmente definida como método
de
tratamiento de "salvamento" en los casos impropios,
facilitando el recubrimiento de la porción más anterolateral de la cabeza femoral y
previniendo la subluxación o el crecimiento lateral de la epífisis, también, en
la subluxación lateral de la
cabeza, la inadecuada cobertura o la cadera en
"bisagra" asociada a
las formas severas; la Osteotomía
de Chiari, que favorece la cobertura
lateral de la cabeza deformada y/o aplastada, más no subyuga el rozamiento lateral a la abducción y
puede
incrementar la insuficiencia glútea; la Queilectomía, intervención anteriormente utilizada que significa la sustracción de fragmentos de la cabeza femoral que protruyen en la porción anterolateral, con la idea de mejorar la movilidad y evitar el fenómeno de abducción en bisagra.
(p. 12)
Kaneshiro (2017) coincide en el hecho de que, tratar
de contener la cabeza femoral dentro
del acetábulo, es
el
objetivo del tratamiento de esta condición, con
la
finalidad de asegurar que se mantenga
un buen rango de movimiento en la cadera. La estrategia
para tratar esta patología incluye:
- Un corto
período de reposo
en cama
para
aliviar el dolor
intenso.
- Limitar la cantidad de peso que se coloca en la pierna mediante la restricción
de actividades como
correr.
- Fisioterapia para ayudar a mantener los músculos
de la pierna y la cadera
fuertes.
- Tomar medicamento antiinflamatorio, como ibuprofeno, para aliviar la rigidez en
la articulación de la cadera.
- Usar
una férula o un dispositivo ortopédico
para ayudar con
la contención.
- Usar
muletas o un caminador.
Cuando otros tratamientos no funcionen, es posible
que se necesite una
intervención quirúrgica
que puede tratarse
de desde
un alargamiento de un músculo de la ingle hasta una
osteotomía. Dependerá de la gravedad de la complicación y
de la forma de la cabeza de la articulación
de la cadera la elección
precisa del tipo de operación.
Para
Pessler (2017) el tratamiento
se resume a: reposo e inmovilización,
por una parte, y
ocasionalmente, cirugía. Expone que el tratamiento ortopédico
se trata de "reposo en cama prolongado, tracción móvil, cabestrillos y
escayolas y férulas en abducción para contener la cabeza femoral." Refiere que
otros expertos proponen la osteotomía subtroncantérea con fijación
interna y deambulación precoz. Por otra parte, indica que a pesar de lo efectivo que ha
evidenciado ser en pruebas iniciales el uso de
los bifosfonatos, estos
estudios aún no son concluyentes.
Sin tratamiento, la evolución suele
ser prolongada, pero
autolimitada
(en general, 2-3
años). Cuando la enfermedad por fin se vuelve quiescente, la distorsión residual de la cabeza femoral y
el
acetábulo predispone a artrosis degenerativa secundaria. Con tratamiento, las secuelas son menos graves. Los niños pequeños y
los niños con menos destrucción de la cabeza femoral cuando se
diagnostica tienen
los mejores resultados.
Conclusiones.
Es evidente
que la ELCP sigue concibiéndose
como una patología en constante investigación, sobre todo en el hecho de tratar de determinar definitivamente su etiología, para
así favorecer un mejor
manejo de ella, en general.
Entre
los factores de riesgo asociados destacaron el de la edad (de
2 a
8 años), sexo masculino, raza
blanca, anomalías
genéticas (mutaciones
genéticas), retraso en la maduración esquelética, déficit del crecimiento y crecimiento desproporcionado, estatura baja, bajo peso al
nacer (BPN), privación social
y
económica
y
traumatismo
y
trastornos
del sistema
de coagulación.
El diagnóstico se basa en una sospecha sintomatológica, que luego pudiera constatarse mediante
una secuencia de
radiografías convencionales, aunque
en
algunos casos se
procede
con la gammagrafía y/o ecografía. Ahora
bien, en las primeras etapas es mejor la IRM puesto que es
posible que los cambios en las primeras radiografías sean poco detectables, casos estos en los que se retarda
el
diagnóstico por algunos meses, inclusive existiendo manifestaciones
sintomatológicas típica de la
patología.
Finalmente, basado en el referido consenso generalizado de
la especialidad ortopédica
relativo a la idea de
mantener la cabeza femoral dentro del acetábulo como medida estratégica
para evitar presiones deformantes sobre la epífisis femoral en la fase de reparación o de plasticidad biológica, prevenir la osteoartritis de la cadera con su indeseable cortejo clínico, promover su esfericidad, asegurar que se
mantenga un buen rango de
movimiento en la cadera y minimizar
los cambios artrósicos secundarios a esta patología.
Bibliografía.
Hernández, S., Romero, B., Osorto, R., & Madrid, A. (2014). Enfermedad de Legg–Calvé–
Perthes. Revista Médica Hondureña,
82(2), 18-20.
Hunt, N., García, C., Abiuso, V., Hernández, J., Gomez, R., & Rostion, C. (2012). Enfermedad
de
“Legg- Calvé-PERTHES” en la infancia. Revista Pediatría Electrónica, 9(2),
1-18.
Kaneshiro,
N. (5 de Septiembre de 2017). Enfermedad de Legg-Calve-Perthes. Obtenido de
Medline Plus: https://medlineplus.gov/spanish/ency/article/001264.htm
Krames
StayWell.
(2018). Cuando
su
hijo tiene la enfermedad de Legge Calvé Perthes.
Recuperado el
23
de
10
de
2019,
de
M
health:
https://www.mhealth.org/patient- education/89364
Lucile Packard
Children’s Hospital
Stanford.
(2019). Enfermedad
de Legg-Calvé-Perthes.
Obtenido de Stanford Children’s Health : https://www.stanfordchildrens.org/es/topic/default?id=legg-calv-perthesdisease-90- P05879
Mayo Clinic. (20 de Noviembre
de 2018). Enfermedad de Legg-Calvé-Perthes. Obtenido de
Mayo Clinic:
https://www.mayoclinic.org/es-es/diseases-conditions/legg-calve-perthes-
disease/symptoms-causes/syc-20374343
Mínguez, M., & Salom, M. (2015). Enfermedad de Legg-Calvé-Perthes. Conceptos actuales.
Revista Española
de Cirugía Osteoarticular, 50(261), 79-82.
Padilla, F., Maya, L., Bolaños, G., & Guerrero, D. (2019). El posible
origen de la enfermedad de
Legg-Calvé-Perthes. Revista Médica del Instituto Mexicano del Seguro Social, 57(1), 36-
41.
Pavone, V., Chisari, E., Vescio, A., Lizzio, C., Sessa, G., & Testa, G. (18 de Marzo de 2019).
Etiología de la enfermedad de Legg-Calvé-Perthes: una revisión sistemática.
World
Journal of Orthopedics,
10(3), 145-165.
Pessler, F. (Febrero de 2017). Enfermedad de Legg-Calvé-Perthes. Obtenido de Manual MSD:
https://www.msdmanuals.com/es/professional/pediatr%C3%ADa/trastornos-
%C3%B3seos-en-ni%C3%B1os/enfermedad-de-legg-calv%C3%A9-perthes
Rampal, V., Clément, J.-L., &
Solla, F. (Abril de 2017). Enfermedad de Legg-Calvé-Perthes:
clasificaciones y factores pronósticos. Clinical Cases in Mineral Bone Metabolism, 14(1),
74-82.
Vargas, I., & Martínez, Ó. (Abril de 2012). Enfermedad de Legg-Calvé-Perthes.
Revisión actualizada. Semergen, 38(3), 167-174.
Wiig, O. (Marzo de 2009).
Enfermedad de
Legg-Calvé-Perthes.
Obtenido de Orphanet:
https://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=ES&Expert=2380

RECONOCIMIENTO-NOCOMERCIAL-COMPARTIRIGUAL CC BY-NC-SA
ESTA LICENCIA PERMITE A OTROS ENTREMEZCLAR,AJUSTAR Y CONSTRUIR A PARTIR DE SU OBRA CON FINES NO COMERCIALES,SIEMPRE Y CUANDO LE RECONOZCAN LA AUTORÍA Y SUS NUEVAS CREACIONES ESTÉN BAJO UNA LICENCIA CON LOS MISMOS TÉRMINOS.



