
Fátima Janina
Palacios Moreira
a; Jonathan Ramón Palacios
Moreira
b; María Julia
Larrea Villacis c; Victor Enrique
Vallejo Romero d; María Angélica Mendoza Intriago e;
María Katherine Reyes
Mera f
Riesgos
y cuidados a los pacientes diagnosticados
con una meningitis
bacteriana
Risks and care for patients diagnosed with
bacterial meningitis
Revista Científica
Mundo de la Investigación
y el Conocimiento.
Vol. 3 núm. 4., diciembre,
ISSN: 2588-073X,
2019, pp. 417-437
DOI: 10.26820/recimundo/3.(4).diciembre.2019.417-437
URL: http://recimundo.com/index.php/es/article/view/758
Código UNESCO: 3205 Medicina Interna
Tipo de Investigación: Artículo
de Revisión
© RECIMUNDO; Editorial Saberes del
Conocimiento,
2019
Recibido: 15/09/2019 Aceptado: 23/11/2019 Publicado:
30/12/2019
Correspondencia: janina_510@hotmail.com
a. Médica Cirujana;
Médico Residente de
Terapia
Intensiva
del Hospital
Gustavo Domínguez
Zambrano;
janina_510@hotmail.com; Portoviejo.
b. Médico Cirujano; Médico Residente de Terapia Intensiva del Hospital IESS Portoviejo;
yop_cerebreid@hotmail.com; Portoviejo.
c. Médico; Médico Residente del IESS Portoviejo; julialarrea2345@hotmail.com; Portoviejo.
d. Médico Cirujano; Médico Residente del IESS Portoviejo; victor-vallejo91@hotmail.com; Portoviejo.
e. Médico Cirujano; Hospital Napoleón Dávila Córdova; marangie_73@hotmail.com; Chone.
f. Médico Cirujano; Hospital General IESS Manta; katty_reyesmera12@hotmail.es; Manta.
RESUMEN
En
diversas investigaciones
y estudios de casos alertan que la meningitis es la infección del sistema nervioso central más común, caracterizada
por la inflamación de las meninges (aracnoides
y piamadre), también puede afectar
al
encéfalo, con la posibilidad
de propagarse a todo el eje cerebroespinal.
Por esta razón, se ha dejado de usar el término meningoencefalitis como sinónimo de meningitis, como enfermedad infecciosa y una
urgencia médica es considerada la meningitis bacteriana aguda.
La mortalidad
secundaria
alcanza hasta 37% y se estiman las secuelas neurológicas en 52% de los adultos supervivientes.
El diagnóstico y tratamiento oportunos son muy importante porque su repercusión en la evolución de la enfermedad es vital. Sin embargo, esta enfermedad no tiene signo patognomónico y representa un reto del clínico moderno para realizar un diagnóstico oportuno.
Es imprescindible que, tanto el
neurólogo como el médico general conozcan las condiciones y las características de
la población, para evitar retrasos en el diagnóstico y finalmente secuelas neurológicas irreversibles
en el paciente y
la familia. Los estudios observacionales son de carácter demográfico, lo que permite a los médicos que sean apropiados para establecer metas orientadas a una determinada acción. El
objetivo de esta revisión es proporcionar un
resumen y describir el comportamiento clínico, diagnóstico, riesgos, tratamiento y hallazgos clínicos
en la población con meningitis infecciosa.
Palabras Claves: Epidemiología,
morbilidad, Streptococcus pneumoniae, neumococo, Staphylococcus
aureus, meningococo,
meningitis bacteriana.
ABSTRACT
In various investigations and case studies they warn that meningitis is the most common central nervous system infection, characterized
by inflammation of the meninges (arachnoid and pia
mater), it can also affect the brain, with the possibility of spreading to the entire cerebrospinal axis. For this reason, the term meningoencephalitis has been discontinued as a synonym for meningitis,
as
an infectious disease and a medical emergency
is considered acute bacterial meningitis. Secondary mortality
it
reaches up to 37% and neurological sequelae are estimated in 52% of surviving adults. Timely
diagnosis and treatment are very important because their impact on
the
evolution of the disease is
vital. However, this disease has no pathognomonic sign and represents a challenge for the modern clinician to make a timely diagnosis. It is essential
that both the neurologist and the general
practitioner know the conditions and characteristics of the population, to avoid delays in diagnosis and finally irreversible neurological sequelae
in the patient
and
family. Observational studies are
demographic in nature, which allows physicians to be appropriate to set goals for a particular action. The objective of this review is to provide
a summary and describe the clinical behavior,
diagnosis, risks, treatment and clinical findings in the population with infectious meningitis.
Key Words: Epidemiology,
morbidity, Streptococcus pneumoniae, pneumococcus, Staphylococcus aureus,
meningococcus, bacterial meningitis.
Introducción.
La
meningitis bacteriana (MB) es la inflamación de las meninges (aracnoides y piamadre) y
sus estructuras como el encéfalo, resultando de una infección bacteriana del líquido
cefalorraquídeo (LCR)
y ventrículos. Siendo actualmente una
emergencia médica y una causa importante de morbilidad o mortalidad en el mundo. El diagnóstico, así como el tratamiento oportuno tiene una importante repercusión en la evolución
de la enfermedad. (Rodrigo Blamey,
2014) (Valle Murillo &
Amparo Carrillo, 2017) (Martínez Hernández &
Cornejo
Juárez, 2017)
Una variedad de estudios
acepta el Streptococcus pneumoniae como el germen
que ocasiona, con mayor frecuencia, meningitis en los adultos. La mortalidad alcanza 37 %, aumenta
en relación
directa con el incremento de
los factores de riesgo producidos por
un mal pronóstico, y en los
adultos supervivientes las secuelas neurológicas se estiman en 52 %. (Martínez
Hernández &
Cornejo Juárez, 2017)
Estos factores de mal pronóstico
favorecen un aumento de
las complicaciones como lo son: las sistémicas (falla cardiaca, coagulación intravascular
diseminada, hiponatremia) y las
neurológicas (edema cerebral, crisis convulsivas, hidrocefalia, vasculitis del sistema
nervioso central, déficits visuales, afasia, hipoacusia, déficits motores, lesión de nervios
craneales). Las complicaciones menos comunes serían los abscesos cerebrales, la ventriculitis, las colecciones
subdurales infectadas (empiema) o estériles (higromas). (Valle Murillo & Amparo Carrillo, 2017) (Martínez Hernández & Cornejo Juárez, 2017)
De
las evidencias neuropatológica, hay que considerar a la
encefalitis y la meningitis como entidades nosológicas diferentes, pues la sintomatología
y los signos clásicos de
cada una casi siempre son predominantes en cada caso y los agentes etiológicos en muy pocas ocasiones coinciden. (Valle Murillo
& Amparo Carrillo, 2017).
Fundamentalmente, las meningitis, son de origen infeccioso y no infeccioso; las bacterias, los virus, los hongos y los parásitos están entre los agentes causantes
más
frecuentes
de esta enfermedad. (Martínez
Hernández & Cornejo Juárez, 2017). Entre las bacterias que con mayor
frecuencia la causan están Streptococcus pneumoniae, Haemophilus influenza y Neisseria
meningitidis.
Las meningitis bacterianas (MB)
pueden ser clasificadas de acuerdo con distintos criterios. Según el medio donde se adquiere, pueden ser infecciones
asociadas a
la atención nosocomiales (Laguna
del
Estal, y otros, 2010) o comunitarias.
(Heyman, 2005). La meningitis bacteriana
adquirida en la comunidad (MBAC), por lo regular es el resultado de la hematógena
de los microorganismos a
partir de focos de infección distantes, especialmente
de las vías respiratorias.
(KwangSik, 2003).
No obstante, para la salud pública global
este grupo de enfermedades aún resulta un serio reto,
a pesar de los avances alcanzados con el desarrollo de vacunas efectivas, la terapia antibiótica, y
la disponibilidad de una atención médica intensiva de alta calidad. (Tebruegge & Curtis, 2008). Su impacto social está causado por su morbilidad; afecta a
todas las edades, y en especial a
los niños, se estima que ocurren al menos 1,2 millones de casos anualmente en todo el mundo, y entre el
10-20 % de los sobrevivientes suelen
quedar con graves secuelas
neurológicas
permanentes.
Frecuentemente tienen un rápido desenlace fatal entre los enfermos, llegando a causar hasta
135
000 muertes cada año en el mundo. (Costerus, Brouwer, Bijlsma, & van de Beek, 2017). Sin
embargo, la comprensión del comportamiento de
las MB a través del tiempo, constituye
una importante herramienta
para la prevención
y control de este letal grupo de enfermedades.
Metodología.
La revisión que se presenta en
este trabajo
es de
tipo documental con análisis de bibliografía,
la recopilación de
la información se ha elaborado a
través de una investigación de medios Electrónicos, Se realizó un estudio descriptivo como parte de una exploración y análisis deductivo- inductivo de las múltiples
fuentes disponibles de
literatura nacional e internacional sobre el tema de
estudio. Aquí se consideran los aportes más importantes de ciertos autores y el objetivo perseguido es dejar abierta
la investigación para futuros casos
que den soporte a nuevos estudios.
Resultados.
Las meninges son cubiertas del cerebro
que cumplen la función de proteger al encéfalo. El
flujo arterial para el encéfalo llega por
cuatro arterias, dos carótidas internas y dos vertebrales que forman la arteria basilar, lo cual se une al polígono de Willis que da origen a los seis grandes vasos
que irrigan la corteza cerebral. (Musher,
2000).
En los plexos coroideos hay soluciones de continuidad entre las células endoteliales de la pared capilar, pero las células epiteliales
coroideas están
densamente entretejidas
y entrelazadas.
El líquido cefalorraquídeo (LCR) ocupa los ventrículos y el espacio subaracnoideo.
Entre el 50 y
70 % del LCR se forma en los plexos coroideos, el resto a lo largo
de las paredes ventriculares y alrededor de los vasos sanguíneos.
El LCR en los ventrículos fluye a través de Luschka y Magendie y
se absorbe por las vellosidades aracnoides
que son proyecciones
cerradas
del
espacio del LCR y se
canaliza a venas
en
especial a los
senos venosos cerebrales. (Scott J, Hall,
& Dagan, 1996).
A una presión de 112mmhg de LCR, que es la presión promedio normal, con un rango presión
lumbar del LCR normalmente de 70 -180mmhg. La velocidad de formación de LCR es
independiente de la presión intraventricular. La
filtración y la absorción son iguales. Por debajo de una presión de 8mmhg de
LCR,
la absorción cesa. Se acumulan grandes cantidades de
líquido cuando la capacidad de absorción de las vellosidades aracnoides
disminuye. Si se acumula líquido
próximamente al bloqueo de
los agujeros de Luschka
y Magendie o existe obstrucción dentro del sistema ventricular, se produce una hidrocefalia interna o no comunicante. (Kaplan & Mc Kay,
2001).
Las meninges y el LCR tienen la función de proteger al encéfalo. La
duramadre está firmemente unida al hueso, el encéfalo mismo se sostiene
dentro de las aracnoides
por los vasos sanguíneos, las raíces de
los nervios y múltiples trabéculas aracnoides.
El dolor producido por la deficiencia del LCR ilustra su importancia para sostener al
encéfalo. (Tunkel,
Florman , & Sheld,
2002).
La meningitis es la
reacción inflamatoria de las células leptomeníngeas y del espacio
subaracnoideo ante
los agentes de
naturaleza tumoral, infecciosa, química o autoinmune que se identifican por alteraciones bioquímicas y
celulares del Líquido Céfalo Raquídeo
(LCR). Es una de las enfermedades del sistema
nervioso central (SNC) que mantiene
una elevada tasa de
morbimortalidad. En los Estados Unidos
se reportan entre 3
y 5 casos por 100.000 habitantes y es
aún más frecuente en países
subdesarrollados. Aunque en los últimos 15 años
se han desarrollado avances terapéuticos, continúa siendo una preocupación en Pediatría, enfrentando diversos problemas como; cambios en su epidemiología, como la resistencia de Streptococcus pneumoniae
a la
penicilina, y la ausencia de vacunas adecuadas para
la prevención de al menos dos
de los agentes causales más
importantes: Neisseria meningitidis y S.
pneumoniae.
La meningitis bacteriana se asocia con una elevada incidencia de complicaciones y de riesgos
de morbilidad crónica. Esta infección es posiblemente una de las más
graves en los lactantes y los
niños mayores. La variedad de la meningitis bacteriana
que
aparece en el período neonatal y su tratamiento, suele ser diferente de
la meningitis que afecta a
los lactantes mayores y a
los niños. En cambio, los modelos
clínicos de la meningitis de los períodos
neonatal y postnatal pueden ser similar,
sobre todos en pacientes
de
1-2 meses de edad, en
quienes
la meningitis puede deberse al
Estreptococo B, H influenzae
de tipo B, Estaphilococo aureus, Neisseria
meningitidis, Meningococo y al
Neumococo.
La
incidencia de la meningitis bacteriana es relativamente alta y deber
incluirse en el diagnóstico diferencial de los lactantes con estado febril que presentan alguna alteración del estado mental, irritabilidad o manifestaciones de otras alteraciones de las funciones neurológicas. (Epstein,
2000).
La meningitis
bacteriana aguda es la inflamación
de las leptomeninges, aracnoides,
piamadre y líquido cefalorraquídeo que son causadas por bacterias. Este proceso afecta también el epitelio ependimario y el líquido cefalorraquídeo ventricular. Las meningitis bacterianas más frecuentes
son las debidas a microorganismos
piógenos que inducen una
respuesta inflamatoria en el
líquido
cefalorraquídeo y ocasionan un cuadro agudo. Otras bacterias que pueden ocasionar
con mucha menor frecuencia meningitis son:
Brúcelas, Micobacterium tuberculosis y las Espiroquetas causantes de la sífilis y la leptospirosis, suelen ser
procesos subagudos o crónicos y cursan con
pleocitocis ligera o moderada en el líquido cefalorraquídeo de predominio linfocitario. (Conly & Lester, 2003).
La
organización Mundial de la Salud (World Health Organization, 2001), reporta que
en el sudeste de
Asia el porcentaje de cultivos negativos en casos de MBAC puede
llegar a 60%
en Tailandia, a 87% en China y a 48% en Hong
Kong. Por otra parte, en un estudio en Grecia (Karanika, y otros, 2009)
reportan 20.4 % de cultivos negativos de casos diagnosticados como MBAC
Epidemiología de los Agentes Infecciosos
Se estiman 170.000 defunciones cada año en todo el mundo por meningitis
bacteriana, por
lo cual sigue siendo una amenaza para
la
salud global (Sáfadi & Cintra, 2010;) (PAHO, 2001).
Representan la tercera o cuarta causa de ingreso
en terapias intensivas
pediátricas, con una letalidad
del 15-30%. (Solórzano,
Miranda, & Díaz, 2002).
Haemophilus influenzae, Streptococus pneumoneae y Neisseria meningitidis son responsables
de la mayoría de los casos que
ocurren después del periodo neonatal. Desde la utilización de la vacuna conjugada contra Haemophilus influenzae tipo b (Hib),
los otros dos gérmenes pasaron a ser
los agentes más frecuentes,
pero con la disponibilidad de
la vacuna neumocócica
conjugada quedaría Neisseria meningitidis en el primer lugar, siendo esta la
única bacteria que
es
capaz de producir
epidemias (Sáfadi & Cintra, 2010; Achtman, 1995)
(Achtman, 1995) (Peltola, Roine, Leinonen, Kuisma,
& Mata, 2010).
Entre
los serotipos responsables de
las formas graves destacan el A, B, C, X, Y y W135 en orden alfabético. En orden de
riesgo epidémico y de
brotes, el grupo A
es el más peligroso,
en especial en el cinturón de la meningitis (África Sub Sahariana); el grupo B representa el 80% de estas enfermedades en Europa y ha causado epidemias severas y persistentes por 10 años o más; en la Región de las Américas, los serogrupos B y C han sido los predominantes (World Health Organization, 2002) (Achtman, 1995).
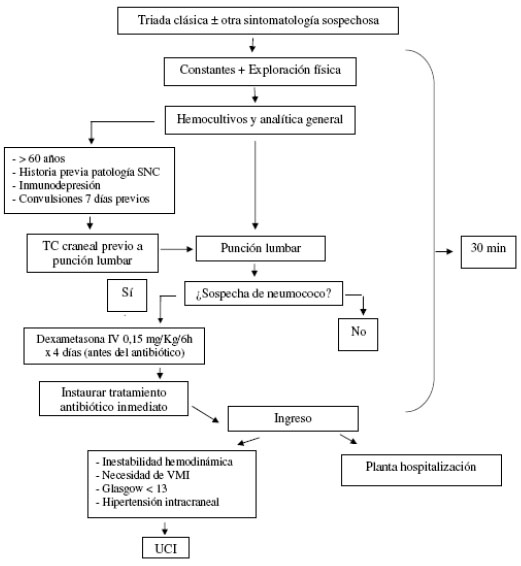
Figura 1. Criterio clínico en diagnóstico de Meningitis Bacteriana. (Franco Huerta, 2017)
Como criterio clínico se toma en consideración la historia
y el examen físico del paciente;
como criterio de laboratorio, el licuóral (aspecto, citología, bioquímica, bacterioscopia directa por
coloración de Gram, cultivo y contra inmune
eletrofuresencia) y de
hemocultivo. Es decir, se realiza la valoración del
paciente considerando
los resultados de
los siguientes
elementos:
• Si el paciente
presenta convulsión, irritabilidad, vómitos, cefalea, fontanela abombada, cianosis, signo de irritación meníngea (Kerning), signo de irritación meníngea (Brudzinski) y rigidez de nuca.
• Se podrá observar el LCR con aspecto turbio, de aspecto xantocrómico y con aspecto de agua de roca.
• La prueba de Pandy positiva, puede presentar una celularidad
del
LCR normal.
• Los
valores en porcentajes de polimorfonucleares (PMN) en
LCR.
• La frecuencia de
pacientes con
porcentaje
de mononucleares
en LCR.
• La disminución
de los valores de glucorraquia.
• El
Gram del LCR
Hallazgos
de Laboratorio.
En la analítica general los resultados son inespecíficos. En el hemograma se suele conseguir leucocitos con predominio de
formas inmaduras, aunque en casos de infección aguda puede aparecer leucopenia y trombopenia. Para
descartar una coagulación intravascular diseminada
(CID) se debe realizar estudio de coagulación. Otras alteraciones
analíticas clarificaran la
severidad del cuadro (acidosis metabólica,
hiperlactacidemia, hiponatremia).
Determinaciones en
suero:
- Recuento de leucocitos: tiene la menor capacidad predictiva de MB por debajo de la
Reacción
en cadena de la polimerasa (PCR)
y la Procalcitonina (PCT).
- PCR: Se ha de ser cauto en su interpretación porque su elevación se produce también en
procesos
inflamatorios y víricos.
- Procalcitonina (PCT): Parece razonable considerar siempre
la posibilidad de una MB
cuando la PCT inicial sea > 0,25-0,5 ng/ml. La PCT supera a la PCR en los pacientes pediátricos, en adultos y en
los ancianos, sin las limitaciones
que presenta la PCR.
- Lactato sérico: no tiene capacidad para distinguir la etiología bacteriana de la vírica ni otras causas de síndrome de respuesta inflamatoria sistémica (SRIS) no infeccioso. Por tanto, su uso en las meningitis agudas se recomienda como factor pronóstico de gravedad y mortalidad, como respuesta al tratamiento.
Hemocultivos.
Los hemocultivos (HC) son positivos en un 50-90% de los casos, particularmente en casos de meningitis meningocócica, bajando la efectividad si se
toman luego de
la administración de antibioterapia
Estudio de líquido cefalorraquídeo.
Imprescindible para el diagnóstico
de meningitis, permitiendo realizar el diagnóstico diferencial
de infección del
SNC y distinguir las infecciones bacterianas
de las
no bacterianas.
Lo primero que se debe realizar es la obtención de la punción lumbar (PL),
luego la realización de
pruebas de imagen. Al ejecutar
la PL con prioridad es conveniente medir presión en el LCR
(utilizar reglas desechables de presión raquídea).
Se
necesitan un número de tubos y unos volúmenes mínimos por cada tubo (10 ml) para:
- Bioquímica y
citología:
un mínimo de 2
ml repartidos en 2 tubos.
- Tinción de Gram, cultivos, determina los antígenos bacterianos, los criptococo, la reacción
en cadena de la polimerasa (PCR) (virus
neurotropos, bacterias): un mínimo
de 2-3 ml.
- Hay que dejar claro, que en los casos clínicos en los que necesario solicitar cultivo de hongos, mico-bacterias, antígenos bacterianos, PCR para
virus o bacterias (meningitis decapitadas), antígeno de Cryptococcus neoformans, serología de sífilis u otra. Se debe enviar la máxima cantidad de muestras posible
de LCR.
Siempre que se debe
solicitar la serología
en LCR, para
ellos se requieren datos en suero de las determinaciones en
LCR:
a) Recuento de leucocitos: El número total de leucocitos en el LCR, representa un menor
valor para el diagnóstico
que el resto de parámetros estudiados
en el
LCR.
b) Proporción de
PMN:
Este parámetro junto con la disminución
de la glucorraquia
y la concentración del lactato en LCR, son los valores determinantes con mayor significación estadística,
ya que, a partir del
50% de PMN, se descarta la MB frente a MV.
c) Proteinorraquia: Diversos estudios recientes en niños, adultos y ancianos publican que la
capacidad de predecir con este valor cada vez es menor, en comparación con la proporción
de PMN,
glucorraquia o concentración
de lactato.
d) Glucorraquia: El valor de glucosa en LCR no es el parámetro más adecuado para diagnosticar entre las meningitis agudas, por ello se debe calcular el cociente entre la
glucorraquia y la glucemia, y se establece que el punto de
ajuste es de 0,36 resultando un excelente
valor del cociente [(glucosa LCR)
/ (glucosa sérica)], con una sensibilidad y
especificidad del
92,9% simultáneamente.
e) Lactato: Su concentración en LCR es independiente de la del lactato sérico, aunque debe tenerse en cuenta que sus valores disminuyen notablemente si se ha administrado una dosis
previa de antibioterapia. Este
es
el marcador más seguro
para diagnosticar MB entre
las determinaciones de LCR que se analizan.
f) PCR: Es útil en casos con LCR negativos (para pacientes pre-tratados) en cultivo y tinción.
Presenta una
mayor sensibilidad y rapidez (160 min) que los métodos convencionales.
g)
PCT: Una publicación reciente compara la potencia diagnóstica de la PCT en suero y en
LCR,
concluyendo que la determinación en suero es mucho
más útil que en LCR, por
lo tanto, este último en
la actualidad no se recomienda su valoración.
h) Tinción
de Gram.
i) Detección de antígenos bacterianos con técnicas inmunológicas: Se basan en la detección precoz de polisacáridos capsulares específicos, siendo muy útiles en pacientes pre-tratados
con tinción de Gram y cultivos negativos. Según el agente etiológico su sensibilidad
es variable (78-100 % H. influenzae, 67-100 % S.pneumoniae, 50-93 % N. meningitidis, 69-
100
% S.agalactiae). Actualmente no se aconseja su uso rutinario. Debido que un resultado
negativo no descarta infección meníngea.
Para mejorar el pronóstico de un paciente con MB, es necesario realizar de forma precoz un diagnóstico y emplear un tratamiento adecuado, con
el objetivo de preservarle la
vida al paciente,
además prevenir de secuelas, y así garantizarle una adecuada calidad de vida futura, cuya magnitud
está relacionada directamente con el tiempo de evolución del proceso. (Divo de A, 1990). Por esta razón resulta fundamental la identificación precisa y rápida del agente etiológico, que permita
orientar al médico tratante sobre
la instauración de una terapia antimicrobiana dirigida al germen en
cuestión, necesitándose para
esto contar con medios eficaces de diagnóstico que
no solo deben ser
precisos sino
además oportunos.
Tratamiento.
Tratamiento empírico.
Debe realizarse teniendo
en cuenta la
tinción de Gram, guarda relación
con la edad y factores
predisponentes. De esta forma, en un paciente adulto sano, los gérmenes a cubrir serían S.
pneumoniae, N. meningitidis, y con
menos frecuencia
H. influenzae y
Streptococcus del
grupo B. En pacientes mayores de
50 años, inmunodeprimidos, esplenectomizados, embarazadas y neonatos, cubrir
también L. Monocytogenes.
1. Tratamiento de elección: cefalosporina de tercera generación, siendo preferible cefotaxima
frente a ceftriaxona por mejor tolerancia y seguridad a
dosis elevadas, añadiendo ampicilina si existe
sospecha de infección por L. monocytogenes. En algunos casos no se
han
aislado S. pneumoniae
con
concentración mínima inhibitoria (CMI)
a cefotaxima >2 mg/L
por lo que no es necesario añadir vancomicina.
2.
Pacientes oncohematológicos, VIH mal controlados o que reciban tratamiento inmunosupresor o terapia biológica: ampliar
cobertura a Bacilos Gram negativos y el tratamiento
de elección sería meropenem + vancomicina +
ampicilina.
3. Infección asociada a cuidados sanitarios (ingreso en el último mes, visitas a hospital de día o pacientes en hemodiálisis): añadir cobertura
para
Cocos Gram positivos con vancomicina. Los
microorganismos más frecuentes en este
caso
son Staphylococcus coagulasa negativos (S. epidermidis), S. aureus, P. acnes y bacilos Gram negativos (E. coli,
Enterobacter,
Citrobacter, Serratia y P. aeruginosa).
4.
Pacientes alérgicos a b-lactámicos: Levofloxacino + vancomicina + rifampicina.
Tratamiento dirigido.
Una vez identificado el agente etiológico causante de la MB, y
su susceptibilidad in vitro, el
tratamiento antimicrobiano empírico debe
ser
modificado, a fin de prescribir el tratamiento
farmacológico más adecuado.
a)
Streptococcus
pneumoniae:
El tratamiento antimicrobiano en la meningitis por
S.
pneumoniae clásicamente
ha sido Penicilina G sódica a dosis altas. La emergencia de cepas resistentes a penicilina, hace que hoy en
día el tratamiento
de elección cambie, si la cepa aislada presenta una CMI
a penicilina de 0,1-1
mg/L, o incluso superior sería una cefalosporina de 3ª generación.
En cepas con CMI a cefotaxima (Chaudhuri, y otros, 2008) 2 mg/L se debe realizar un tratamiento combinado de
cefotaxima + vancomicina. Hay autores que recomiendan la adicción
de rifampicina (900
mg/día) al tratamiento anterior, que estaría indicado también en niños (Chaudhuri, y otros, 2008) 3 meses. Otra
alternativa en alérgicos sería levofloxacino. La
vancomicina
en
monoterapia está contraindicada (concentraciones en LCR muy bajas o indetectables a las
48h).
b)
Neisseria meningitidis
En muchos casos la meningitis
meningocócica se acompaña de sepsis grave, habiéndose comprobado una mayor mortalidad por retrasos en el tratamiento antimicrobiano. La recomendación es la administración
parenteral de cefalosporinas
de 3a generación
en el momento en que se determine
la sospecha de este
cuadro clínico.
Alternativas en alérgicos: rifampicina
+ aztreonam en pediatría
y levofloxacino o aztreonam
en adultos.
c) Haemophilus
influenzae
La
emergencia
de cepas productoras de b-lactamasas, y resistentes a cloranfenicol requiere que las
cefalosporinas de 3a generación sean consideradas como el tratamiento de
elección. Una
vez
conocido el antibiograma
se puede desecalar a ampicilina si la cepa no es productora de
b- lactamasas. Las fluorquinolonas
se han utilizado y pueden ser una alternativa terapéutica en casos
que no se pueda utilizar
b-lactámicos. En pediatría, la alternativa
en
alérgicos sería
rifampicina + aztreonam.
d)
Staphylococcus
aureus:
Asociado principalmente a neurocirugía y a traumatismo craneoencefálico
(TCE) con heridas penetrantes. El tratamiento de elección es cloxacilina
valorando la asociación de rifampicina o
fosfomicina. En zonas donde
la prevalencia de S. aureus meticilin resistente
(SARM) es elevada
el
tratamiento de elección sería
vancomicina (+/- rifampicina o fosfomicina)
hasta disponer de antibiograma.
Otra
opción de tratamiento, en caso de contraindicación para glicopéptidos o CMI a
vancomicina
>1 mg/L, es linezolid.
e) Listeria
monocytogenes:
El tratamiento de elección es ampicilina valorando la asociación de amionoglucósidos (vigilar
deterioro de la función renal). En casos de alergia a b-lactámicos
el tratamiento alternativo es trimetoprim-sulfametoxazol.
Otras alternativas son meropenem, levofloxacino y linezolid, aunque existe
todavía poca evidencia sobre su
uso.
f) Enterococcus
spp.
El tratamiento de elección es ampicilina a la
que se
puede asociar gentamicina.
En pacientes alérgicos o en cepas productoras de b-lactamasas, vancomicina es una buena alternativa, valorando también en estos casos la adición gentamicina. Linezolid es una alternativa en casos de resistencia a vancomicina
y daptomicina podría ser
otra opción, pero
con menos evidencias.
g)
Bacilos
Gram negativos:
Las
meningitis por BGN suelen
ser nosocomiales o relacionados
con la asistencia sanitaria. La mayoría
de las meningitis
agudas
causadas
por
Enterobacterias (Escherichia coli,
Klebsiella pneumoniae.), pueden ser tratadas con cefalosporinas de 3a generación y en el caso de
Pseudomonas
aeruginosa sería de elección el uso de ceftazidima.
Sin embargo, el incremento de
resistencias en este
grupo, hace necesario considerar otras opciones. Meropenem es una buena opción frente a BGN
hiperproductores de b- lactamasas
(Citrobacter spp, Enterobacter spp,
o Serratia marcescens), o bien productores de b-lactamasas
de espectro ampliado
o que muestran resistencia a cefalosporinas
de 3a generación.
Profilaxis
La
forma bacteriana y viral requiere de un contacto directo (saliva, tos, estornudos) con las personas o portadores cercanos,
o un
contacto indirecto a través de fómites
o vehículos (vasos, pañales, cubiertos, utensilios de uso personal).
Todo profesional médico que tenga
sospecha de meningitis en un paciente
lo deberá comunicar
el
caso y de ser necesario, instaurar y facilitar
la quimioprofilaxis.
Está indicada la
realización de quimioprofilaxis sólo en los contactos de meningitis
menigocócica o por Haemophilus. Ante un caso de meningitis meningocócica, los sujetos
con indicación
de quimiprofilaxis son:
- Convivientes
con el paciente.
- Personas que han tenido
contacto directo con las secreciones
nasofaríngeas del paciente
(besos,
utensilios de comer…).
- Personal médico sólo si se han aspirado secreciones, hecho reanimación boca a boca o intubación.
- Pasajero
de asiento
contiguo en viajes de > 8h.
Otro
elemento de transmisión es la
coexistencia en conglomerados humanos como cuarteles, internados,
guarderías, escuelas, residencias
estudiantiles y campamentos vacacionales. Si
el caso se ha declarado en una
de estas instalaciones,
se deben realizar quimioprofilaxis al personal del
hayan
hecho
actividades
en común.
Conclusión.
La
meningoencefalitis bacteriana aguda presenta una evolución y pronóstico incierto en las primeras 24-48h, mientras se espera la confirmación definitiva
del
diagnóstico y se determina el agente externo
que
lo ha provocado, la condición del paciente se puede agravar, acercándolo a un desenlace fulminante. La
rápida valoración y confirmación del diagnóstico de
un subtipo bacteriano, permite iniciar tratamiento
antibiótico empírico aún en esperas de los resultados definitivos
de microbiología. Sin
precisar el verdadero
estado del paciente tras haber superado las primeras etapas, son probable las repercusiones y secuelas neurológicas, por lo que el seguimiento
y control posterior de las mismas
es primordial en la recuperación del individuo.
Importante también informar a la familia, amigos y el conjunto de allegados, el método de transmisión del meningoencefalitis bacteriana, la cual se
produce a través de
secreciones
respiratorias y saliva, aunque es necesario un contacto íntimo y continuado para la transmisión. En el caso de contagio,
el sistema inmunitario del nuevo huésped lucha contra la bacteria eliminándolo en la mayoría
de los casos. Existe
otra manera en la que pueden verse expuestos, es a raíz de
infecciones de vías aéreas como otitis, sinusitis; o también,
complicaciones postraumáticas. Como
medida preventiva, se procederá a comenzar con tratamiento antibiótico dentro de las primeras 24 horas tras la confirmación del caso matriz, y sólo en aquellos individuos que hayan estado en contacto íntimo
con el paciente.
Bibliografía.
Achtman, M. (1995). Global epidemiology of meningococcal disease. En K. Cartwright, Meningococcal disease
(págs. 159–175). Chichester, United Kingdom: John Wiley & Sons,
Ltd.
Chaudhuri, A., Martínez Martín, P., Kennedy, P., Andrew Seaton, R., Portegies,
P., & Bojar, M. (2008).
EFNS
guideline on the management of
community-acquired bacterial meningitis.
En EFNS Task Force on acute bacterial meningitis in older chidren
and adults (Vol. 15,
págs. 649-59). Eur J Neurol.
Conly , J., & Lester,
A. (2003). Cerebrospinal
fluid
as a diagnostic body fluid (75
ed.). J Med.
Costerus, J., Brouwer , M., Bijlsma , M., & van de Beek , D. (2017). Community-acquired bacterial meningitis. CurrOpin Infect Dis. Obtenido
de https://insights.ovid.com/pubmed?pmid=27828810
Divo de A, M. (1990). Diagnóstico etiológico de Meningitis Bacteriana en población
pediátrica.
Maracay, Aragua,
Venezuela:
Universidad de Carabobo.
Epstein , F. (2000). Bacterial Meningitis: Pathogenesis, pathophisiology and progress. N
Engle J Med .
Franco
Huerta, M. (2017).
Protocolo
de
Meningitis
Bacteriana
Aguda.
España:
SESCAM.
Obtenido de http://sescam.castillalamancha.es/sites/sescam.castillalamancha.es/files/documentos/pdf
Heyman, D. (2005). El control
de las enfermedades transmisibles.
(18ª ed.).
Washington, D.C.: OPS.
Kaplan
, S., & Mc Kay
, R. (2001). Association
between preadmisión
Oral Antibiotic therapy
and CSF finding and secuela
caused by Haemophilus Influenzae type b
Meningitis. Ped Infec Dis .
Karanika , M., Vasilopoulou , V.,
Katsioulis , A.,
Papastergiou , P., Theodoridou , M., & Hadjichristodoulou, C. (2009). Diagnostic clinical
and laboratory findings in response to predetermining bacterial pathogen: data from the Meningitis
Registry. doi:PloS One
KwangSik, K. (2003). Pathogenesis of bacterial meningitis: from bacteraemia to neuronal injury.
Nat
Rev
Neurosci . Obtenido de https://www.nature.com/articles/nrn1103
Laguna del Estal , P., García Montero, P., Agud Fernández , M., López Cano , M., Castañeda
Pastor,
A., & García Zubiri
, C. (2010). Meningitis
bacteriana por bacilos gramnegativos en
adultos. Rev Neurol.
Martínez
Hernández, L., & Cornejo Juárez
, P.
(2017). Meningitis bacteriana aguda
por S. pneumoniae. (M. I.
Méx, Ed.) Obtenido de http://www.scielo.org.mx/pdf/mim/v33n1/0186-4866-mim-33-01-00132.pdf
Musher
, D.
(2000). Infections caused by Streptococcus pneumoniae: Clinical spectrum,
pathogenesis, immunity
and treatment. Clin Infect Dis .
PAHO.
(2001). Definiciones de Caso Enfermedades Meningocócicas
(Vol. 22). Boletín
Epidemiológico.
Peltola,
H., Roine, I., Leinonen, M., Kuisma, L., &
Mata, A. (2010). Diagnosis of treptococcus
pneumoniae and Haemophilus influenzae type b meningitis by identifying DNA from cerebrospinal
fluid-impregnated
filter paper
strips (Vol. 29). Pediatr Infect Dis J.
Rodrigo Blamey, D. (2014).
Meningitis bacteriana aguda. (R. M. Condes, Ed.) Obtenido de https://www.clinicalascondes.cl/Dev_CLC/media/Imagenes/PDF%20revista%20m%C3% A9dica/2014/3%20abril/14-Dr.Blamey.pdf
Sáfadi , M., &
Cintra , O. (2010;). Epidemiology of meningococcal disease in Latin America:
current situation and opportunities for prevention (Vol. 32). Neurol
Res.
Scott
J , A., Hall , A., & Dagan , R. (1996). Serogroup specific epidemiology of Streptococcus
pneumoniae: associations with age, sex and geography in 7.000 episodes of
invasive disease. Clin
infect Dis .
Solórzano , S., Miranda , N., & Díaz, R. (2002). Meningoencefalitis bacteriana.
En Enferm Infecc
Microbiol (Vol. 22, págs. 2-13).
Tebruegge, M., & Curtis , N. (2008).
Epidemiology, etiology, pathogenesis, and diagnosis of recurrent bacterial meningitis. ClinMicrobiol. Obtenido
de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2493086/pdf/0009-08.pdf
Tunkel , A., Florman , S., & Sheld , W. (2002). Bacterial Meningitis: recent advances in pathophysiology and
treatment. Ann Int
Med .
Valle Murillo, M., &
Amparo Carrillo, M. (2017). Infecciones
del Sistema Nervioso Central, parte
1: Meningitis,
Encefalitis
y
Absceso cerebral.
(M.
Neurociencia, Ed.)
Obtenido de http://revmexneuroci.com/wp-content/uploads/2017/03/RevMexNeu-2017-182-51-65- R.pdf
World Health Organization. (2001).
Report of a meeting on priorities for Pneumococcal and
Heamophilus influenzae type b (Hib) vaccine development and introduction. Geneva.
doi:WHO/V&B/
World Health Organization. (2002).
Meningococcal vaccines. En polysaccharide and polysaccharide conjugate vaccines (Vol.
77, págs. 331-339). Weekly Epid. Record.

RECONOCIMIENTO-NOCOMERCIAL-COMPARTIRGUAL
CC BY-NC-SA
ESTA LICENCIA PERMITE A OTROS ENTREMEZLCAR, AJUSTAR Y CONSTRUIR A PARTIR DE SU OBRA CON FINES NO COMERCIALES, SIEMPRE Y CUANDO LE RECONOZCAN LA AUTORÍA Y SUS NUEVAS CREACIONES ESTÉN BAJO UNA LICENCIA CON LOS MISMOS TÉRMINOS.


