

DOI: 10.26820/recimundo/4.(3).julio.2020.102-117
URL:http://recimundo.com/index.php/es/article/view/854
EDITORIAL: Saberes del Conocimiento
Revista: RECIMUNDO
ISSN: 2588-073X
Tipo de Investigación: Artículo de Revisión
Código UNESCO: 3205 Medicina Interna
Paginas: 102-117

Libia Lizeth Garzón Ospina1; José Leonardo Grisman Laverde2; José Alfonso Albán Tapia3; Jacqueline Paola Olmedo Cahuasquí4
 https://orcid.org/0000-0002-3376-8863
https://orcid.org/0000-0002-3376-8863 https://orcid.org/0000-0003-0131-9112
https://orcid.org/0000-0003-0131-9112 https://orcid.org/0000-0003-3908-6668
https://orcid.org/0000-0003-3908-6668 https://orcid.org/0000-0002-5153-7380
https://orcid.org/0000-0002-5153-7380CORRESPONDENCIA
Libia Lizeth Garzón Ospina
llgarzono@unal.edu.co
Cali, Colombia
La hiponatremia y el síndrome hepatorrenal son complicaciones graves en pacientes con cirrosis y ascitis como resultado de anormalidades circulatorias (vasodilatación esplácnica y sistémica) que se desarrollan con hipertensión portal. Ambas condiciones están asociadas con un mayor riesgo de muerte. La hiponatremia y la insuficiencia renal pueden desarrollarse en pacientes con cirrosis debido a causas distintas a la hipertensión portal. El empeoramiento de la vasodilatación con la consiguiente no osmótica, la liberación de arginina-vasopresina y vasoconstricción renal son el principal mecanismo patogénico para la hiponatremia y síndrome hepatorrenal, respectivamente. Tanto la hiponatremia como el síndrome hepatorrenal presagian un mal pronóstico en el paciente con cirrosis y ascitis. La terapia principal de la hiponatremia consiste en el receptor AVP antagonistas. La terapia principal del síndrome hepatorrenal consiste principalmente en vasoconstrictores. Ambas terapias se consideran terapias "puente" para el trasplante de hígado. Hacer un diagnóstico diferencial preciso es importante tanto terapéutica como pronósticamente. En este artículo, se discute la fisiopatología, el diagnóstico, el diagnóstico diferencial y el tratamiento de la hiponatremia y el síndrome hepatorrenal en pacientes con cirrosis.
Palabras claves: Hiponatremia, síndrome hepatorrenal, cirrosis, ascitis.
Hyponatremia and hepatorenal syndrome are serious complications in patients with cirrhosis and ascites as a result of circulatory abnormalities (splanchnic and systemic vasodilation) that develop with portal hypertension. Both conditions are associated with an increased risk of death. Hyponatremia and renal failure can develop in patients with cirrhosis due to causes other than portal hypertension. Worsening vasodilation with consequent non-osmotic, arginine-vasopressin release, and renal vasoconstriction are the main pathogenic mechanism for hyponatremia and hepatorenal syndrome, respectively. Both hyponatremia and hepatorenal syndrome presage a poor prognosis in the patient with cirrhosis and ascites. The main therapy of hyponatremia consists of AVP receptor antagonists. The main therapy for hepatorenal syndrome consists mainly of vasoconstrictors. Both therapies are considered "bridge" therapies for liver transplantation. Making an accurate differential diagnosis is important both therapeutically and prognostically. In this article, the pathophysiology, diagnosis, differential diagnosis, and treatment of hyponatremia and hepatorenal syndrome in patients with cirrhosis are discussed.
Keywords: Hyponatremia, hepatorenal syndrome, cirrhosis, ascites.
A hiponatremia e a síndrome hepato-renal são complicações graves em pacientes com cirrose e ascite como resultado de anormalidades circulatórias (vasodilatação esplâncnica e sistêmica) que se desenvolvem com hipertensão portal. Ambas as condições estão associadas a um risco aumentado de morte. Hiponatremia e insuficiência renal podem se desenvolver em pacientes com cirrose devido a outras causas além da hipertensão portal. O agravamento da vasodilatação com conseqüente liberação não-osmótica, arginina-vasopressina e vasoconstrição renal é o principal mecanismo patogênico para hiponatremia e síndrome hepatorenal, respectivamente. Tanto a hiponatremia quanto a síndrome hepato-renal apresentam um prognóstico ruim no paciente com cirrose e ascite. A principal terapia da hiponatremia consiste em antagonistas do receptor AVP. A principal terapia para a síndrome hepatorenal consiste principalmente de vasoconstritores. Ambas as terapias são consideradas "ponte" para transplante de fígado. Fazer um diagnóstico diferencial preciso é importante tanto terapeuticamente quanto prognóstico. Neste artigo, são discutidas a fisiopatologia, o diagnóstico, o diagnóstico diferencial e o tratamento da hiponatremia e da síndrome hepatorenal em pacientes com cirrose.
Palavras-chave: Hiponatremia, síndrome hepatorenal, cirrose, ascite.
INTRODUCCIÓN
La hiponatremia y el síndrome hepatorrenal (HRS) son complicaciones graves que ocurren en pacientes con cirrosis y ascitis y se asocian con una supervivencia más baja que en pacientes con cirrosis descompensada (p. Ej., Aquellos que tienen ascitis no complicada, hemorragia varicosa o encefalopatía).Existe, por lo tanto, el desarrollo de estas 2 complicaciones representa una etapa de descompensación adicional de la cirrosis.En el momento del desarrollo de cada una de estas complicaciones, los pacientes tenían valores progresivamente más bajos de presión arterial media indicativos de empeoramiento de la vasodilatación, excreción urinaria de sodio progresivamente más baja y puntuaciones progresivamente más altas de ChildPugh y MELD (Modelo de enfermedad hepática terminal) indicativas de empeoramiento de la función hepática.
La hiponatremia dilucional y el HRS (un tipo de insuficiencia renal exclusiva de pacientes con cirrosis) representan manifestaciones de un continuo de eventos fisiopatológicos derivados de la hipertensión portal y la vasodilatación resultante, que son los principales mecanismos responsables del desarrollo de ascitis(Schrier, Arroyo, Bernardi, Epstein, & M., 1988). En un inicio prospectivo,estudio de cohorte de pacientes con cirrosis y ascitis de nueva aparición que fueron seguidos durante una media de 41 meses, se desarrolló hiponatremia en el 28% de los pacientes, el 11% desarrolló ascitis refractarias y el 8% desarrolló HRS, lo que sugiere un proceso secuencial (de ascitis a hiponatremia a ascitis refractaria a HRS(Planas, Montoliu, & Ballesté, 2006).
Sin embargo, es importante reconocer que la hiponatremia y la insuficiencia renal en el paciente con cirrosis pueden ser el resultado de afecciones que ocurren en pacientes no cirróticos y que resultan de mecanismos fisiopatológicos diferentes al empeoramiento de la hipertensión / vasodilatación portal. Hacer un diagnóstico diferencial preciso es importante tanto desde el punto de vista de pronóstico como terapéutico. Por lo tanto, se revisará la fisiopatología, el diagnóstico, el diagnóstico diferencial y el tratamiento de la hiponatremia y el HRS en pacientes con cirrosis.
Metodología
Para el desarrollo de este proceso investigativo, se plantea como metodología la encaminada hacia una orientación científica particular que se encuentra determinada por la necesidad de indagar en forma precisa y coherente una situación, en tal sentido (Davila, 2015) define la metodología “como aquellos pasos previos que son seleccionados por el investigador para lograr resultados favorables que le ayuden a plantear nuevas ideas”.(p.66)
Lo citado por el autor, lleva a entender que el desarrollo de la acción investigativa busca simplemente coordinar acciones enmarcadas en una revisión bibliográfica con el fin de complementar ideas previas relacionadas a la Hiponatremia y el síndrome hepatorrenal en pacientes con cirrosis a través de una revisión de literatura, para así finalmente elaborar un cuerpo de consideraciones generales que ayuden a ampliar el interés propuesto.
Tipo de Investigación
Dentro de toda práctica investigativa, se precisan acciones de carácter metodológico mediante las cuales, se logra conocer y proyectar los eventos posibles que la determinan, así como las características que hacen del acto científico un proceso interactivo ajustado a una realidad posible de ser interpretada. En este sentido, se puede decir, que la presente investigación corresponde al tipo documental, definido por Castro (2016), “se ocupa del estudio de problemas planteados a nivel teórico, la información requerida para abordarlos se encuentra básicamente en materiales impresos, audiovisuales y /o electrónicos”. (p.41).
En consideración a esta definición, la orientación metodológicapermitió la oportunidad de cumplir con una serie de actividades inherentes a la revisión y lectura de diversos documentos donde se encontraron ideas explicitas relacionadas con los tópicos encargados de identificar a cada característica insertada en el estudio. Por lo tanto, se realizaron continuas interpretaciones con el claro propósito de revisar aquellas apreciaciones o investigaciones propuestas por diferentes investigadores relacionadas con el tema de interés, para luego dar la respectiva argumentación a los planteamientos, en función a las necesidades encontradas en la indagación.
Fuentes Documentales
El análisis correspondiente a las características que predomina en el tema seleccionado, lleva a incluir diferentes fuentes documentales encargadas de darle el respectivo apoyo y en ese sentido cumplir con la valoración de los hechos a fin de generar nuevos criterios que sirven de referencia a otros procesos investigativos. Para (CASTRO, 2016) las fuentes documentales incorporadas en la investigación documental o bibliográfica, “representa la suma de materiales sistemáticos que son revisados en forma rigurosa y profunda para llegar a un análisis del fenómeno”. (p.41). Por lo tanto, se procedió a cumplir con la realización de una lectura previa determinada para encontrar aquellos aspectos estrechamente vinculados con el tema, con el fin de explicar mediante un desarrollo las respectivas apreciaciones generales de importancia.
Técnicas para la Recolección de la Información
La conducción de la investigación para ser realizada en función a las particularidades que determinan a los estudios documentales, tiene como fin el desarrollo de un conjunto de acciones encargadas de llevar a la selección de técnicas estrechamente vinculadas con las características del estudio. En tal sentido, (Bolívar, 2015), refiere, que es “una técnica particular para aportar ayuda a los procedimientos de selección de las ideas primarias y secundarias”. (p. 71).
Por ello, se procedió a la utilización del subrayado, resúmenes, fichaje, como parte básica para la revisión y selección de los documentos que presentan el contenido teórico. Es decir, que mediante la aplicación de estas técnicas se pudo llegar a recoger informaciones en cuanto a la revisión bibliográfica de los diversos elementos encargados de orientar el proceso de investigación. Tal como lo expresa, (Bolívar, 2015) “las técnicas documentales proporcionan las herramientas esenciales y determinantes para responder a los objetivos formulados y llegar a resultados efectivos” (p. 58). Es decir, para responder con eficiencia a las necesidades investigativas, se introdujeron como técnica de recolección el método inductivo, que hizo posible llevar a cabo una valoración de los hechos de forma particular para llegar a la explicación desde una visión general.
Asimismo, se emplearon las técnicas de análisis de información para la realización de la investigación que fue ejecutada bajo la dinámica de aplicar diversos elementos encargados de determinar el camino a recorrer por el estudio, según, (Bolívar, 2015) las técnicas de procesamiento de datos en los estudios documentales “son las encargadas de ofrecer al investigador la visión o pasos que debe cumplir durante su ejercicio, cada una de ellas debe estar en correspondencia con el nivel a emplear” (p. 123). Esto indica, que para llevar a cabo el procesamiento de los datos obtenidos una vez aplicado las técnicas seleccionadas, tales como: fichas de resumen, textual, registros descriptivos entre otros, los mismos se deben ajustar al nivel que ha sido seleccionado.
Resultados
Fisiopatología de la hiponatremia y el síndrome hepatorrenal
La vasodilatación de las circulaciones esplácnica y sistémica es uno de los principales factores que contribuyen al desarrollo de hiponatremia y HRS en la cirrosis (Figura 1). La vasodilatación ocurre después de que la hipertensión portal ha conducido a la formación de colaterales portosistémicos cuando los factores que no han sido bien aclarados (el factor de crecimiento endotelial vascular es uno de ellos) desencadenan la producción de óxido nítrico y otros vasodilatadores(Iwakiri & Groszmann, 2006). Esta vasodilatación conduce a una disminución efectiva volumen arterial y activación de varios sistemas neuroconsumores vasoconstrictores y anti natriuréticos (el sistema renina-angiotensina-aldosterona y el sistema nervioso simpático), lo que lleva a la retención renal de sodio y agua y un aumento en el volumen intravascular, que a su vez conduce a un estado circulatorio hiperdinámico.
En las etapas avanzadas de la cirrosis, la vasodilatación progresiva conduce no solo a una ávida retención de sodio (con formación de ascitis que ahora es refractaria a los diuréticos) sino también a la liberación no osmótica de la hormona antidiurética o arginina vasopresina (AVP). Los efectos biológicos de AVP en el aumento de la reabsorción de agua están mediados por receptores acoplados a proteínas G, específicamente receptores de vasopresina 2 (V2) ubicados en la membrana basolateral de las células principales de los conductos colectores. Cuando se activa mediante AVP, los receptores V2 permiten la translocación de canales de agua selectivos llamados acuaporinas del citosol a la membrana plasmática luminal de los conductos colectores, lo que aumenta la permeabilidad del agua. Este aumento en la reabsorción de agua excede el de la retención de sodio y conduce a hiponatremia dilucional.
La vasodilatación progresiva también conduce a una mayor activación de los sistemas vasoconstrictores (principalmente renina y angiotensina), lo que resulta en vasoconstricción renal y disminución del flujo sanguíneo renal. Además, una disminución relativa del gasto cardíaco en este estado de insuficiencia cardíaca de alto gasto (o miocardiopatía cirrótica) puede contribuir aún más a la disminución del flujo sanguíneo renal(Ruiz-del-Arbol, Monescillo, & Arocena, 2005). Esta disminución en el flujo sanguíneo renal conduce a una disminución de la tasa de filtración glomerular y un tipo de lesión renal prerrenal (es decir, HRS).
La fisiología hepatorrenal como se describió anteriormente puede estar presente en muchos pacientes con cirrosis avanzada que pueden desarrollar HRS sin un evento precipitante obvio. Sin embargo, la mayoría de las veces, el HRS se precipita por factores que causan una disminución en el volumen sanguíneo arterial efectivo, como la pérdida rápida de líquido (p. Ej., Diuresis excesiva y hemorragia gastrointestinal), o empeoramiento de la vasodilatación inducida por fármacos (p. Ej., Nitratos, carvedilol e inhibidores de la enzima convertidora de angiotensina) o mediante una respuesta inflamatoria sistémica (p. ej., infección).
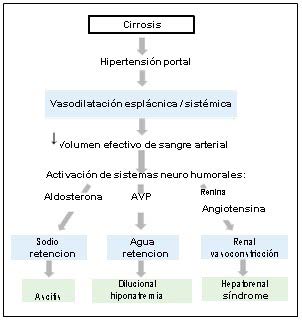
Figura 1. La fisiopatología de la hiponatremia y el síndrome hepatorrenal (HRS) en la cirrosis
Fuente: (Cohn, 1976)
En la figura Nº1 se observa que la cirrosis y la hipertensión portal conducen al desarrollo de vasodilatación esplácnica y sistémica que causa una disminución en el volumen circulatorio efectivo, lo que a su vez conduce a la activación de varios sistemas neuroconsumores vasoconstrictores y anti natriuréticos (sistema renina-angiotensina-aldosterona, sistema nervioso simpático y no osmótico). liberación de hormona antidiurética). Inicialmente, esto conduce a la retención de agua y sal, lo que aumenta el volumen intravascular y permite la formación continua de ascitis. Sin embargo, con el empeoramiento de la cirrosis (o con factores precipitantes), la vasodilatación esplácnica / sistémica empeora, lo que lleva a un aumento significativo en la liberación de hormona antidiurética y retención de agua (en exceso de retención de sodio) y, por lo tanto, a hiponatremia dilucional. La vasodilatación máxima y la activación de los sistemas vasoconstrictores (renina-angiotensina) conducen a la vasoconstricción renal y al desarrollo de HRS.
Hiponatremia en Cirrosis
La hiponatremia en la cirrosis se ha definido arbitrariamente como un nivel de sodio sérico de menos de 130 mEq / L y está presente en aproximadamente un quinto de los pacientes con cirrosis descompensada (Angeli, Wong, & Watson, 2006). Es importante tener en cuenta que, aunque no cumple con esta definición, un sodio sérico el nivel de menos de 135 mEq / L en pacientes incluidos en la lista de trasplante de hígado se ha asociado con un aumento de la mortalidad, independientemente del puntaje del Modelo de enfermedad hepática en etapa terminal (MELD) (Kim, Biggins, & Kremers, 2008). De hecho, la incorporación del nivel de sodio en suero en MELD (referido como MELD-Na) se ha demostrado que predice la supervivencia con mayor precisión que MELD solo, y probablemente se usará pronto en lugar de MELD para la asignación de órganos.
Diagnóstico diferencial de la hiponatremia en la cirrosis
La hiponatremia en la cirrosis puede ser:
Es importante distinguir entre la hiponatremia hipervolémica e hipovolémica para proporcionar un tratamiento adecuado. Como la hiponatremia hipervolémica es el resultado del aumento de la retención de sodio y agua, los pacientes a menudo tienen edema dependiente y ascitis refractaria tensa. El sello clínico de la vasodilatación sistémica es un bajo MAP; los pacientes con hiponatremia dilucional son, por lo tanto, generalmente hipotensos y pueden tener niveles de creatinina superiores al valor basal. Por otro lado, en la hiponatremia hipovolémica, Los pacientes a menudo están deshidratados. Aparecen secos, sin ascitis ni edema.
Significado clínico de la hiponatremia en la cirrosis
La hiponatremia se asocia con un riesgo significativamente mayor de muerte por cirrosis. (Kim, Biggins, & Kremers, 2008) demostraron que el sodio sérico es un predictor importante de mortalidad, independiente de la puntuación MELD entre los pacientes adultos incluidos en la lista de trasplante de hígado.
En pacientes con cirrosis, se ha observado que la hiponatremia es un factor predictivo independiente para el desarrollo de encefalopatía hepática(Guevara, Baccaro, & Torre, 2009). Se cree que un aumento en el amoníaco y otras neurotoxinas junto con una disminución en el sodio sérico actúan de forma sinérgica para causar un cambio en el medio osmótico del cerebro, que produce edema cerebral y encefalopatía hepática. Se ha observado que el desarrollo gradual de la hiponatremia está asociado con mioinositol y osmolitos orgánicos en el cerebro, medidos por espectroscopía de resonancia magnética, probablemente como un mecanismo compensatorio para mantener homeostasis del fluido cerebral.
La presencia de hiponatremia dilucional se asocia con ascitis severa, peritonitis bacteriana espontánea y HRS (Angeli, Wong, & Watson, 2006). Como era de esperar, los pacientes con hiponatremia y ascitis también tienen un alto riesgo de tener o desarrollar HRS. La hiponatremia dilucional se asocia con deterioro relacionado con la salud calidad de vida (CVRS). En pacientes con cirrosis y ascitis, se descubrió que la hiponatremia es un predictor independiente de la disminución de las puntuaciones de los componentes físicos y mentales del cuestionario SF-36 que evalúa la CVRS (Solà, Watson, & Graupera, 2012). Un estudio reciente del efecto de la hiponatremia y la encefalopatía hepática en la CVRS demostró que los pacientes con cirrosis e hiponatremia, pero sin encefalopatía hepática tienen una CVRS más pobre según lo medido por el Perfil de Impacto de Enfermedad, a pesar de una mejor cognición, en comparación con aquellos con encefalopatía concomitante. Además, la hiponatremia previa al trasplante es un predictor independiente de mortalidad a corto plazo después del trasplante de hígado.
La corrección rápida de la hiponatremia en el postoperatorio puede dar lugar a una desmielinisis pontina central, una complicación neurológica letal que puede dar lugar a manifestaciones irreversibles. como disartria, disfagia, paraparesia, trastornos del comportamiento y síndrome cerrado. Además de las complicaciones neurológicas, la hiponatremia previa al trasplante se ha asociado con un mayor riesgo de insuficiencia renal e infecciones bacterianas en el primer mes posterior al trasplante.
Manejo
El reconocimiento del tipo de hiponatremia (hipervolémica versus hipovolémica) es clave en el manejo de la adaptación. El tipo más fácil de tratar es la hipernatremia hipovolémica porque la eliminación del factor precipitante (principalmente diuréticos) y la administración de soluciones isotónicas intravenosas para expandir el volumen plasmático a menudo corrigen la anomalía.
Por otro lado, el tratamiento de la hiponatremia hipervolémica es difícil y está dirigido a disminuir el exceso de agua libre en la circulación. La restricción de agua de 1 a 1.5 L / d es el tratamiento estándar actual para la hiponatremia hipervolémica. Sin embargo, el cumplimiento del paciente es muy pobre, y el efecto resultante sobre los niveles séricos de sodio es modesto.
Estos incluyen aumentar la excreción renal de agua libre de solutos, aumentar el volumen sanguíneo arterial efectivo y mejorar la vasodilatación sistémica y esplácnica.
Vaptans, o antagonistas de los receptores V2, son una clase de medicamentos que aumentan la excreción renal de agua libre de solutos al bloquear la reabsorción de agua, lo que conduce a la producción voluminosa de orina hipotónica. Un metaanálisis reciente de ensayos aleatorizados y controlados de vaptanes (satavaptán, tolvaptán [Samsca, Otsuka] y lixivaptán) para la hiponatremia en pacientes con cirrosis, en los que el resultado primario fue la muerte, mostró un pequeño efecto beneficioso transitorio sobre la hiponatremia, pero no efecto sobre la mortalidad o la insuficiencia renal (Dahl, Gluud, Kimer, & Krag, 2012). El metaanálisis concluyó que los datos no respaldaban el uso rutinario de vaptanos en la cirrosis. Tolvaptan es el único vaptan administrado por vía oral aprobado por la Administración de Alimentos y Medicamentos de EE. UU.
Debido a que se han observado elevaciones significativas en las enzimas hepáticas con el uso de tolvaptán en pacientes con enfermedad renal poliquística autosómica dominante, las intervenciones para corregir la disminución del volumen sanguíneo arterial efectivo en pacientes con hiponatremia incluyen la retirada de diuréticos y el uso de albúmina intravenosa. Se encontró que la infusión de albúmina en un número muy pequeño de pacientes es útil en estudios no aleatorios a corto plazo. Sin embargo, el beneficio a largo plazo del uso de albúmina sigue siendo desconocido.
Finalmente, el uso de vasoconstrictores sería racional y, aunque no han sido probados específicamente para la hiponatremia, la prueba de concepto y los ensayos controlados aleatorios de vasoconstrictores para HRS han demostrado que están asociados con aumentos en los niveles séricos de sodio(Garcia-Tsao, Parikh, & Viola, 2008).
Síndrome Hepatorrenal
La creatinina sérica es un predictor independiente de mortalidad en la cirrosis descompensada, por lo que es un componente de la puntuación MELD, que es un predictor robusto del riesgo de mortalidad a los 4 meses y, por lo tanto, se utiliza actualmente para determinar la prioridad para el trasplante orto tópico de hígado. La disfunción renal en la cirrosis es la insuficiencia orgánica con el mayor impacto pronóstico en pacientes con insuficiencia hepática aguda o crónica (Bajaj, O’Leary, & Reddy, 2014).
El HRS es un tipo de lesión renal prerrenal exclusiva de pacientes con cirrosis descompensada. Como se mencionó anteriormente, el HRS es una insuficiencia renal funcional resultante de la vasoconstricción renal, que a su vez es el resultado de una vasodilatación extrema en los lechos vasculares esplácnicos y sistémicos. HRS es un estado de hipovolemia eficaz asociado con bajo MAP, gasto cardíaco relativamente disminuido y resistencia vascular sistémica reducida. Hay 2 tipos de HRS: HRS-1 y HRS-2. HRS-1 se caracteriza por un deterioro brusco de la función renal (una forma de lesión renal aguda [IRA]), a menudo precipitada por una infección bacteriana como la peritonitis bacteriana espontánea. HRS-2 es una forma más crónica de disfunción renal (similar a la enfermedad renal crónica [ERC]) que a menudo se asocia con ascitis refractaria.
Definición del síndrome hepatorrenal
Según (Salerno, Gerbes, Ginès, Wong, & Arroyo, 2007) HRS se define por un nivel de creatinina sérica mayor de 1.5 mg / dL (> 133 µmol / L) y se establece cuando no hay mejoría en la creatinina sérica después de 2 días de interrupción de diuréticos y expansión de volumen adecuada con albúmina en presencia de ascitis y en ausencia de shock, tratamiento reciente con fármacos nefrotóxicos u otras enfermedades renales parenquimatosas. Aunque esta definición puede aplicarse a pacientes con HRS-2, la IRA en cirrosis se ha redefinido muy recientemente, y esa definición se expande a continuación.
Síndrome hepatorrenal – 1 (lesión renal aguda) HRS-1 fue definido por el International Club ofAscites como la duplicación de la concentración inicial de creatinina sérica a un nivel superior a 2.5 mg / dL (> 221 µmol / L) en menos de 2 semanas. Este criterio ha sido revisado recientemente como resultado de una conferencia de consenso entre los miembros del International Club ofAscites en 2012, teniendo en cuenta que
1) El uso de un límite de creatinina de 1.5 mg / dL en pacientes con cirrosis descompensada que probablemente tener una masa muscular baja y / o en una paciente con cirrosis ya podría reflejar una función renal marcadamente deteriorada y que
2) era necesario un marco de tiempo para distinguir entre lesión renal aguda y crónica.
Basado en nuevas definiciones de IRA por nefrología criterios de AKIN (Red de lesión renal aguda), RIFLE (Riesgo, lesión, falla, Pérdida de la función renal y enfermedad renal en etapa terminal), y KDIGO (enfermedad renal: mejora de los resultados globales), La IRA en cirrosis ahora se define de la siguiente manera: (1) un aumento absoluto en la creatinina sérica de al menos 0.3 mg / dL (≥26.5 µmol / L) dentro de las 48 horas o (2) un aumento porcentual en la creatinina sérica de al menos 50% del valor inicial que se sabe, o se presume, que ocurrió dentro de los 7 días anteriores. (Si la medición de referencia no está disponible, una medición de creatinina sérica dentro de los 3 meses previos a la admisión puede considerarse como referencia (Angeli, Ginès, & Wong, 2015).
Estudios previos en pacientes con cirrosis en los que el AKI se definió según criterios similares de AKIN (un aumento en la creatinina sérica de ≥0.3 mg / dL o ≥50% desde el inicio en <48 horas) mostró que el AKI en pacientes ambulatorios con cirrosis y pacientes hospitalizados con cirrosis se asocia con una alta tasa de mortalidad incluso cuando los niveles de creatinina sérica están por debajo del umbral de 1,5 mg / dL(Wong, O’Leary, & Reddy, 2013). Aunque cuanto más avanzada es la etapa de AKI, mayor es la tasa de mortalidad, la progresión de la lesión renal a etapas más altas de AKIN es el predictor independiente más fuerte de mortalidad en pacientes hospitalizados con cirrosis. Por lo tanto, establecer el diagnóstico de HRS en una etapa más temprana con más sensibilidad,los criterios facilitarán el diagnóstico y la intervención tempranos y posiblemente evitarán la progresión a etapas avanzadas.
Síndrome hepatorrenal – 2 (enfermedad renal crónica) HRS-2no se ha caracterizado tan bien como HRS-1. HRS-2 es un tipo funcional de ERC en el que los niveles de creatinina aumentan gradualmente. Como tal, probablemente debería definirse utilizando los mismos criterios utilizados en nefrología, es decir, por una disminución en la tasa de filtración glomerular (a <60 ml / min) durante más de 3 meses. Sin embargo, debe tenerse en cuenta que las ecuaciones basadas en creatinina (p. Ej., Modificación de la dieta en la enfermedad renal [MDRD]) funcionan mal en pacientes con cirrosis, particularmente en aquellos con cirrosis descompensada.38-40 Las ecuaciones basadas en cistatina C funcionan mejor, pero, cuando no está disponible, se debe usar la ecuación MDRD-6.
Como la esteatohepatitis no alcohólica se está convirtiendo en una causa importante de enfermedad hepática en etapa terminal en pacientes con diabetes / síndrome metabólico, un número creciente de pacientes con cirrosis tendrán ERC estructural (p. Ej., Nefropatía diabética o hipertensiva), y luego pueden desarrollar insuficiencia renal funcional superpuesta fracaso debido a la fisiología de HRS (lesión renal aguda en crónica). Es posible que estos pacientes no tengan las características reconocidas de los pacientes con HRS puro, ya que pueden tener una PAM alta, y el uso de vasoconstrictores en este contexto requeriría investigación.Los datos sobre HRS-2 y sobre ERC aguda-crónica en cirrosis son escasos; por lo tanto, el resto de este artículo se refiere a HRS-1.
Diagnóstico diferencial del síndrome hepatorrenal
HRS-1 no es el único tipo de IRA que puede complicar la condición de los pacientes con cirrosis. Hacer un diagnóstico diferencial preciso es clave para determinar el manejo más apropiado.
El AKI ocurre en aproximadamente el 20% de los pacientes hospitalizados con cirrosis (Dahl, Gluud, Kimer, & Krag, 2012). Aproximadamente dos tercios de los casos son prerrenales (es decir, funcionales), de los cuales la mayoría corresponden a azotemia prerrenal, mientras que el HRS constituye solo un pequeño porcentaje de casos (<20% de causas totales de IRA); un tercio de los casos son intrarrenales (es decir, estructurales), más comúnmente necrosis tubular aguda; y menos del 1% son postrenales (obstructivas). El principal diferencial de AKI en la cirrosis consiste en azotemia prerrenal, necrosis tubular aguda y HRS. La azotemia prerrenal es causada por hipovolemia (p. Ej., Diuresis agresiva, diarrea y / o sangrado gastrointestinal) o por otras causas de disminución del volumen sanguíneo efectivo inducido por infecciones o vasodilatadores. La azotemia prerrenal responde a la expansión del volumen, pero no se requieren vasoconstrictores y diálisis. La necrosis tubular aguda ocurre principalmente en pacientes que presentan shock o antecedentes de exposición a nefro toxinas / agentes de contraste. La necrosis tubular aguda se trata con terapia de reemplazo renal si está indicada, pero el volumen no debe expandirse. El HRS es causado por una vasodilatación extrema (con o sin un precipitante) con la consiguiente vasoconstricción renal y se trata con vasoconstrictores y expansión de volumen.
Diagnóstico del síndrome hepatorrenal
El HRS sigue siendo un diagnóstico de exclusión. Por lo tanto, el primer paso en su diagnóstico es excluir la presencia de daño renal estructural (necrosis tubular aguda, glomerulonefritis y nefritis intersticial aguda) o daño renal obstructivo (uropatía obstructiva) y distinguir entre azotemia prerrenal y HRS (los 2 tipos funcionales de AKI en cirrosis).
Esto requiere tomar una historia clínica cuidadosa para determinar si hay evidencia de infección, sobre diuresis, hemorragia gastrointestinal, uso reciente de vasodilatadores o nefro toxinas (incluidos medicamentos antiinflamatorios no esteroideos) y / o paracentesis de gran volumen sin el uso de albúmina. La evidencia del síndrome de respuesta inflamatoria sistémica y la evaluación del estado del volumen durante el examen físico son importantes. Se debe evaluar la presencia de biomarcadores de orina tradicionales (sedimento urinario, excreción fraccional de sodio [FeNa] y albúmina urinaria), así como una ecografía renal para excluir la uropatía postobstructiva. El tratamiento de la infección es importante en presencia de IRA en la cirrosis, independientemente de la causa de la IRA.
Estudios recientes demuestran la utilidad potencial de los biomarcadores urinarios para diferenciar la necrosis tubular aguda de la azotemia prerrenal y el HRS. Los niveles de lipocalina asociada a gelatinasa de neutrófilos urinarios, interleucina, proteína de unión a ácidos grasos de tipo hepático y albúmina urinaria son más altos en pacientes con necrosis tubular aguda, más bajos en pacientes con azotemia prerrenal e intermedios en aquellos con HRS (Belcher, Sanyal, & Peixoto, 2014).
Cuanto mayor es el número de biomarcadores de orina que están por encima de un umbral predeterminado, mayor es la probabilidad de necrosis tubular aguda. A excepción de la albúmina de orina, estos biomarcadores no están ampliamente disponibles en los Estados Unidos. El límite para la albúmina urinaria que indica la presencia de necrosis tubular aguda es de 44 mg / dL o más. FeNa en el punto de corte habitual del 1% no tiene ningún valor en el diagnóstico diferencial de AKI en la cirrosis porque prácticamente todos los pacientes con cirrosis y ascitis tienen un FeNa de menos del 1%. Curiosamente, en un estudio reciente, los niveles de FeNa por debajo del 0.5% (particularmente aquellos <0.3%) fueron útiles para identificar una causa prerrenal de IRA, con niveles iguales o inferiores al 0.1% identificando a aquellos con HRS (Belcher, Sanyal, & Peixoto, 2014).
Si hay evidencia de lesión estructural, es decir, si un paciente se presenta con shock (séptico o hemodinámico), tiene antecedentes de exposición a nefro toxinas (incluidos los medicamentos antiinflamatorios no esteroideos) o tinte de contraste, yesos presentes en la orina o tiene biomarcadores urinarios elevados (albuminuria> 44 mg / dL en ausencia de ERC) y un FeNA mayor al 0.5%, o si hay evidencia de uropatía obstructiva en la ecografía, el paciente generalmente no debe ser tratado con expansión de volumen y debe tener pruebas confirmatorias realizado (incluyendo biopsia renal si es necesario) para establecer el diagnóstico y la terapia específica. A veces, el diferencial entre la necrosis tubular aguda y el HRS se vuelve difícil porque, en el HRS avanzado, la vasoconstricción renal puede provocar daño tubular.
Aunque los mismos precipitantes de la azotemia prerrenal (particularmente aquellos que empeoran la vasodilatación, como las infecciones) también pueden precipitar el HRS, en el tratamiento de la azotemia prerrenal del precipitante y la expansión del volumen debe conducir a la resolución de la IRA. Cuando el paciente tiene un volumen claramente reducido, la solución de solución salina intravenosa (p. Ej., Para una sobrediuresis) o sangre (p. Ej., Hemorragia gastrointestinal) puede proporcionar una expansión del volumen. Si el paciente no parece tener un volumen reducido y / o tiene evidencia de síndrome de respuesta inflamatoria sistémica, el mejor expansor de volumen es la albúmina intravenosa a una dosis empírica recomendada de 1 g / kg de peso corporal por día (que podría dividirse en 2 dosis), con una dosis máxima de 100 g / d. Una vez que se han iniciado la expansión del volumen y los antibióticos (en aquellos con infección sospechada o confirmada), El curso de AKI debe reevaluarse en 24 a 48 horas. Si el nivel de creatinina sérica ha mejorado significativamente o ha vuelto a la línea de base, la terapia debe continuar, ya que es probable que se trate de azotemia prerrenal. Si el nivel de creatinina ha disminuido solo ligeramente, el manejo del paciente debe ser individualizado y puede incluir repetir el trabajo de AKI. Si el nivel de creatinina no ha cambiado o ha empeorado, es probable que el paciente tenga HRS, y se puede iniciar una terapia específica. Es importante tener en cuenta que al menos 2 días de observación habrían transcurrido desde el momento del diagnóstico de AKI hasta el inicio del tratamiento para HRS. El manejo del paciente debe ser individualizado y puede incluir la repetición del trabajo de AKI. Si el nivel de creatinina no ha cambiado o ha empeorado, es probable que el paciente tenga HRS, y se puede iniciar una terapia específica. Es importante tener en cuenta que al menos 2 días de observación habrían transcurrido desde el momento del diagnóstico de AKI hasta el inicio del tratamiento para HRS. El manejo del paciente debe ser individualizado y puede incluir la repetición del trabajo de AKI. Si el nivel de creatinina no ha cambiado o ha empeorado, es probable que el paciente tenga HRS, y se puede iniciar una terapia específica. Es importante tener en cuenta que al menos 2 días de observación habrían transcurrido desde el momento del diagnóstico de AKI hasta el inicio del tratamiento para HRS.
También es importante señalar que los pacientes con HRS tienen enfermedad hepática avanzada (puntuación mediana de Child-Pugh, 11.2), MAP bajo (MAP promedio, 74 mmHg), sodio sérico bajo (sodio sérico mediano, 127 mEq / L) y ascitis comúnmente refractaria a los diuréticos. Además, y como se mencionó anteriormente, un FeNA de 0.1% o menos es fuertemente sugestivo de HRS (Belcher, Sanyal, & Peixoto, 2014).
Tratamiento del síndrome hepatorrenal – 1
El trasplante de hígado es el tratamiento definitivo para el HRS porque es la única opción terapéutica asociada con una mejor supervivencia. Sin embargo, lograr la reversión del HRS es importante antes del trasplante, ya que la función renal previa al trasplante es un predictor independiente tanto a corto plazo como a corto plazo. mortalidad a largo plazo y supervivencia del injerto después de la plantación (Weismüller, Prokein, & Becker, 2008). Se ha observado que los pacientes con HRS tratados con vasopresina tienen resultados posteriores al trasplante similares a los de los pacientes sin HRS sometidos a trasplante. La Asociación Americana para el Estudio de Enfermedades del Hígado recomienda que todos los pacientes con HRS tengan una derivación expedita para el trasplante de hígado (Runyon, 2009).
Vasoconstrictores y Albúmina
La vasodilatación esplácnica y sistémica y la vasoconstricción renal resultante son los principales mecanismos para el desarrollo de HRS. El uso de vasoconstrictores en HRS tiene como objetivo mejorar la vasodilatación esplácnica y / o sistémica, mejorar el volumen sanguíneo efectivo y disminuir la activación de los vasoconstrictores renales, mejorando así la perfusión renal. Los vasoconstrictores se usan junto con la albúmina en la terapia para el HRS. La albúmina actúa como un expansor de plasma y, al unir sustancias vasodilatadoras como el óxido nítrico y al mejorar la miocardiopatía cirrótica, puede proporcionar un efecto beneficioso que va más allá de la expansión del volumen. Por lo tanto, concomitante al uso de vasopresores, se recomiendan infusiones diarias de albúmina (1). g / kg el día 1, seguido de 25-50 g / d) (Planas, Montoliu, & Ballesté, 2006).
Los vasoconstrictores que se han usado en pacientes con HRS incluyen terlipresina, noradrenalina, octreótido más midodrina y vasopresina. En estudios de prueba de concepto, el uso de estos agentes durante más de 3 días se ha asociado con una mejora en la PAM, la tasa de filtración glomerular y los niveles séricos de sodio, con una disminución en la actividad de la renina en plasma. (Angeli, Volpin, & Gerunda, 1999).
La terlipresina es un análogo de vasopresina de acción más prolongada con menos efectos secundarios que la vasopresina y es el vasoconstrictor para el cual hay más datos con respecto al HRS. Los ensayos controlados aleatorios que compararon terlipresina y albúmina con placebo mostraron una mayor tasa de reversión de la HRS (definida en estos estudios como una disminución en el nivel de creatinina sérica a <1.5 mg / dL) en el grupo de terlipresina en comparación con el grupo control (46% vs 11%; odds ratio, 3.76; IC 95%, 2.21-6.39) (Bajaj, O’Leary, & Reddy, 2014).
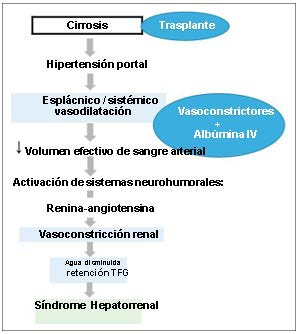
Figura 2. Manejo del síndrome hepatorrenal basado en invirtiendo los principales mecanismos fisiopatológicos
Fuente: (Weismüller, Prokein, & Becker, 2008)
TFG, tasa de filtración glomerular; IV, intravenosa
La terlipresina se administra a una dosis de 1 mg cada 4 horas. Si, después de 3 días de terapia, los niveles de creatinina no han disminuido en un 25%, entonces la dosis de terlipresina puede aumentarse a 2 mg cada 4 horas. Si no se observa la resolución de HRS después de 10 días de tratamiento, se debe suspender el uso de terlipresina(European Association for the Study of the Liver, 2010). Este programa de tratamiento probablemente debería reevaluarse y correlacionarse con los cambios en MAP; es decir, la terapia probablemente deba suspenderse antes en pacientes que no alcanzan un aumento de 10 a 15 mmHg en MAP después de alcanzar las dosis máximas de vasoconstrictores. Debido a que es un vasoconstrictor potente, la terlipresina se ha asociado con eventos adversos significativos, que incluyen isquemia cardíaca e intestinal, hipertensión y arritmias en hasta 40% de los pacientes.
Otra alternativa es la combinación de octreotida y midodrina, que tiene la ventaja de la administración oral / subcutánea, que puede administrarse en entornos de cuidados no intensivos, y tiene un buen perfil de seguridad. Octreotida es un análogo de somatostatina de acción prolongada que causa inhibición de la liberación de hormonas vasodilatadoras, lo que resulta en una disminución de la vasodilatación esplácnica. La midodrina es un agonista adrenérgico α1 que causa vasoconstricción sistémica, mejora el volumen circulatorio efectivo y, por lo tanto, la perfusión renal. El uso de midodrina sola o octreotida sola no se asocia con una mejora en la función renal en la HRS(Angeli, Volpin, & Gerunda, 1999). Sin embargo, se ha demostrado que el uso combinado de midodrina y octreotida junto con albúmina mejora la función renal, aunque faltan ensayos aleatorizados y controlados. A pesar de la falta de pruebas contundentes, La combinación de octreotida, midodrina y albúmina se ha adoptado como terapia de primera línea en países donde la terlipresina no está disponible, como los Estados Unidos.
Octreotida se administra en dosis de 100 µg, por vía subcutánea, 3 veces al día y puede aumentarse a 200 µg 3 veces al día. La midodrina se administra en dosis de 7,5 mg 3 veces al día y se puede aumentar hasta 12,5 mg 3 veces al día. Debido a que esta es una combinación vasoconstrictora débil, si no se observa una mejora en el nivel de MAP o creatinina dentro de los 3 días posteriores al inicio de la midodrina y la octreomarea (durante las cuales la dosis debe aumentarse rápidamente), el paciente debe ser transferido a cuidados intensivos. unidad para la administración de norepinefrina o infusión de vasopresina. La terlipresina es un análogo de vasopresina, por lo que la vasopresina debería ser tan efectiva como la terlipresina.
Un estudio retrospectivo comparó el uso de vasopresina y octreotida para el tratamiento de la HRS y demostró tasas de recuperación más altas con el uso de vasopresina(Kiser, Fish, & Obritsch, 2015). La vasopresina se usa como una infusión continua, comenzando con una dosis baja de 0.01 U / min y titulando hasta un máximo de 0,45 U / min con estrecha monitorización de MAP, producción de orina y efectos secundarios isquémicos. Todos los pacientes que reciben terapias vasoconstrictoras deben ser monitoreados por complicaciones isquémicas y cardiovasculares. Las terapias vasoconstrictoras no se recomiendan en pacientes con cardiopatía isquémica preexistente, enfermedad cerebrovascular, enfermedad arterial periférica, hipertensión o asma. comenzando con una dosis baja de 0.01 U / min y titulando hasta un máximo de 0.45 U / min con un monitoreo cercano de MAP, producción de orina y efectos secundarios isquémicos. Todos los pacientes que reciben terapias vasoconstrictoras deben ser monitoreados por complicaciones isquémicas y cardiovasculares. Las terapias vasoconstrictoras no se recomiendan en pacientes con cardiopatía isquémica preexistente, enfermedad cerebrovascular, enfermedad arterial periférica, hipertensión o asma. comenzando con una dosis baja de 0.01 U / min y titulando hasta un máximo de 0.45 U / min con un monitoreo cercano de MAP, producción de orina y efectos secundarios isquémicos. Todos los pacientes que reciben terapias vasoconstrictoras deben ser monitoreados por complicaciones isquémicas y cardiovasculares. Las terapias vasoconstrictoras no se recomiendan en pacientes con cardiopatía isquémica preexistente, enfermedad cerebrovascular, enfermedad arterial periférica, hipertensión o asma.
Otras terapias
La derivación portosistémica intrahepática transyugular (TIPS) y la diálisis extracorpórea de albúmina se han evaluado en pequeños estudios como terapias alternativas para el HRS. Tres estudios no controlados han demostrado niveles disminuidos de creatinina sérica con TIPS en pacientes seleccionados con HRS, aunque estos estudios combinaron pacientes con HRS-1 y HRS-2. El tratamiento secuencial con vasoconstrictores y albúmina seguido por TIPS mostró una mejora sostenida a largo plazo en la función renal después de TIPS en pacientes que respondieron a la terapia vasoconstrictora. La diálisis extracorpórea de albúmina es una terapia de investigación dirigida a eliminar los factores circulantes que pueden causar vasodilatación.
Conclusión
La hiponatremia y el HRS son complicaciones graves y siniestras en pacientes con cirrosis descompensada. El reconocimiento temprano y el inicio de una terapia adecuada son claves para garantizar la reversión o incluso la desaceleración del proceso. Debido a que los pacientes con HRS a menudo están muy enfermos y requieren tratamiento en una unidad de cuidados intensivos, es necesaria una atención multidisciplinaria coordinada con hepatólogos, el equipo de trasplantes, los nefrólogos y los especialistas en cuidados críticos para unir exitosamente a estos pacientes al trasplante de hígado.
El trasplante de hígado es el único tratamiento definitivo paraHRS, sin embargo, cuestiones importantes con respecto a los cambios enPuntuación MELD con terapia que afectará la asignación de órganosy el uso apropiado del trasplante de hígado / riñón necesitaser abordado en futuras investigaciones científicas.
REFERENCIAS BIBLIOGRÁFICAS
Angeli, P., Ginès, P., & Wong, F. (2015). Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the Inter-national Club of Ascites. J Hepatol, 968-974.
Angeli, P., Volpin, R., & Gerunda, G. (1999). Reversal of type 1 hepatorenal syndrome with the administration of midodrine and octreotide. Hepatology, 1690-1697.
Angeli, P., Wong, F., & Watson, H. (2006). Hyponatremia in cirrhosis: results of a patient population survey. Hepatology, 1535-1542.
Bajaj, J., O’Leary, J., & Reddy, K. (2014). North American Consortium For The Study Of End-Stage Liver Disease Nacseld. Survival in infection-related acute-on-chronic liver failure is defined by extrahepatic organ failures. Hepatology, 250-256.
Belcher, J., Sanyal, A., & Peixoto, A. (2014). Kidney biomarkers and differen-tial diagnosis of patients with cirrhosis and acute kidney injury. Hepatology, 622-632.
Bolívar, J. (2015). Investigación Documental. México. Pax.
Castro, J. (2016). Técnicas Documentales. México. Limusa.
Cohn, J. (1976). Renal hemodynamic alterations in liver disease. . Perspect Nephrol Hypertens, 234-255.
Dahl, E., Gluud, L., Kimer, N., & Krag, A. (2012). Meta-analysis: the safety and efficacy of vaptans (tolvaptan, satavaptan and lixivaptan) in cirrhosis with ascites or hypona-traemia. Aliment Pharmacol Ther, 619-626.
Davila, A. (2015). Diccionario de Términos Científicos. . Caracas: Editorial Oasis.
European Association for the Study of the Liver. (2010). EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol, 397-417.
Garcia-Tsao, G., Parikh, C., & Viola, A. (2008). Acute kidney injury in cirrhosis. Hepatology, 2064-2077.
Guevara, M., Baccaro, M., & Torre, A. (2009). Hyponatremia is a risk factor of hepatic encephalopathy in patients with cirrhosis: a prospective study with time-dependent analysis. Am J Gastroenterol, 1382-1389.
Iwakiri, Y., & Groszmann, R. (2006). The hyperdynamic circulation of chronic liver diseases: from the patient to the molecule. Hepatology, S121-S131.
Kim, W., Biggins, S., & Kremers, W. (2008). Hyponatremia and mortality among patients on the liver-transplant waiting list. N Engl J Med, 1018-1026.
Kiser, T., Fish, D., & Obritsch, M. (2015). Vasopressin, not octreotide, may be beneficial in the treatment of hepatorenal syndrome: a retrospective study. Nephrol Dial Transplant, 1813-1820.
Planas, R., Montoliu, S., & Ballesté, B. (2006). Natural history of patients hospitalized for management of cirrhotic ascites. Clin Gastroenterol Hepatol., 1385-1394.
Ruiz-del-Arbol, L., Monescillo, A., & Arocena, C. (2005). Circulatory function and hepatorenal syndrome in cirrhosis. Hepatology, 439-447.
Runyon, B. (2009). AASLD Practice Guidelines Committee. Management of adult patients with ascites due to cirrhosis: an update. Hepatology, 2087-2107.
Salerno, F., Gerbes, A., Ginès, P., Wong, F., & Arroyo, V. (2007). Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut., 1310-1318.
Schrier, R., Arroyo, V., Bernardi, M., Epstein, & M. (1988). Peripheral arterial vasodilation hypothesis: a proposal for the initiation of renal sodium and water retention in cirrhosis. Hepatology, 1151-1157.
Solà, E., Watson, H., & Graupera, I. (2012). Factors related to quality of life in patients with cirrhosis and ascites: relevance of serum sodium concentration and leg edema. J Hepatol, 1199-1206.
Weismüller, T., Prokein, J., & Becker, T. (2008). Prediction of survival after liver trans-plantation by pre-transplant parameters. Scand J Gastroenterol, 736-746.
Wong, L., O’Leary, J., & Reddy, K. (2013). North American Consortium for Study of End-Stage Liver Disease. New consensus definition of acute kidney injury accurately predicts 30-day mortality in patients with cirrhosis and infection. Gastroenterology, 1187-1198.