

DOI: 10.26820/recimundo/4.(3).julio.2020.118-127
URL:http://recimundo.com/index.php/es/article/view/855
EDITORIAL: Saberes del Conocimiento
Revista: RECIMUNDO
ISSN: 2588-073X
Tipo de Investigación: Artículo de Revisión
Código UNESCO: 3205 Medicina Interna
Paginas: 118-127

Nataly Daniela Ocaña Arguello1; Alexis Patricio Paredes Cruz2; Fuertes Arévalo Raysa Astrid3; Erika Katherine Pazmiño Álvarez4
 https://orcid.org/0000-0001-8392-4679
https://orcid.org/0000-0001-8392-4679 https://orcid.org/0000-0002-9907-3191
https://orcid.org/0000-0002-9907-3191 https://orcid.org/0000-0003-0064-7528
https://orcid.org/0000-0003-0064-7528 https://orcid.org/0000-0002-2879-6704
https://orcid.org/0000-0002-2879-6704CORRESPONDENCIA
Nataly Daniela Ocaña Arguell
oc_333@outlook.com
Quito, Ecuador
Las diferentes pruebas serológicas (IgG, IgM, IgA) para detectar el Toxoplasma Gondii durante el embarazo, son de suma importancia para diagnosticar a tiempo la transmisión vertical de la infección por vía placentaria, y comenzar el tratamiento oportuno para detener la evolución de la enfermedad y mitigar los daños fetales. El tratamiento in útero no es efectivo al 100%, por ello es necesario que al nacer, el niño asintomático o no, continúe el tratamiento indicado por seis meses o un año, para seguir frenando la enfermedad dando oportunidad a que el sistema inmunológico pueda hacerse cargo por sí sólo.
Palabras claves: Toxoplasmosis, congénita, diagnóstico, tratamiento, infección.
The different serological tests (IgG, IgM, IgA) to detect Toxoplasma Gondii during pregnancy are of utmost importance in order to diagnose the vertical transmission of infection via the placental route in time, and to start the appropriate treatment to stop the evolution of the disease. and mitigate fetal harm. In utero treatment is not 100% effective, so it is necessary that at birth, the asymptomatic child or not, continue the indicated treatment for six months or a year, to continue to slow down the disease, giving the immune system an opportunity charge alone.
Keywords: Toxoplasmosis, congenital, diagnosis, treatment, infection.
Os diferentes testes sorológicos (IgG, IgM, IgA) para detectar Toxoplasma Gondii durante a gravidez são de extrema importância para diagnosticar a transmissão vertical da infecção pela via placentária a tempo e iniciar o tratamento adequado para interromper a evolução da doença. . e mitigar os danos fetais. O tratamento no útero não é 100% eficaz, por isso é necessário que, ao nascer, a criança assintomática ou não, continue o tratamento indicado por seis meses ou um ano, para continuar a desacelerar a doença, dando ao sistema imunológico uma taxa de oportunidade sozinha.
Palavras-chave: Toxoplasmose congênita, diagnóstico, tratamento, infecção.
INTRODUCCIÓN
La toxoplasmosis es una vieja enfermedad que el cuerpo humano sano ha sabido contener, y que puede transitar asintomáticamente en la mayoría de los casos. De hecho, más de un tercio de la población mundial ha estado expuesta al Toxoplasma Gondii sin que esto fuera un problema mayor, siempre y cuando su hospedero no fuese una persona con un sistema inmune debilitado o una embarazada. En este último caso, si la mujer ya ha padecido la enfermedad (presenta anticuerpo IgG contra T. Gondii) no es posible que exista el peligro de contagio vertical útero-feto, pero si el contagio se produce muy cerca de la fecundación o durante el embarazo, la enfermedad, que puede llegar a pasar desapercibida para la madre, puede tener un mal pronóstico fetal si no se controla y trata oportunamente.
Tampoco es posible que una mujer que haya tenido un embarazo complicado por toxoplasmosis, en el siguiente embarazo corra con la misma suerte. No obstante, en mujeres inmunodeprimidas por enfermedades como el SIDA, los quistes tisulares que tal vez se alojaron por años en su cerebro, músculo esquelético, miocardio u ojos, puede reactivarse, convirtiéndose en un embarazo de alto riesgo que por lo general no llega a término.
Ciertamente la incidencia de la toxoplasmosis congénita a nivel mundial, es muy baja y varía de una zona a otra, observándose mayor repercusión y efectos adversos en los países del trópico. Dicha incidencia está “entre 1:1000 y 1:10000 nacidos vivos dependiendo de la zona geográfica, estilo de vida y nivel socioeconómico de la población. (Martín Hernández, 2004). Sin embargo, las cifras epidemiológicas han revelado que sus efectos en el feto son más severos que los causados por la rubeola, la sífilis y el herpes juntos, e incluso, hay opiniones científicas sobre la subestimación de su incidencia (Remington & J O, 2001).
Es un hecho que la Toxoplasmosis Congénita (TC) no sólo es responsable de la prematuridad y bajo peso al nacer. Si el feto llegara a sobrevivir a la infección toxoplásmica, el recién nacido pudiera presentar secuelas irreversibles tomando en cuenta que éste microorganismo tiene predilección por el encéfalo y los ojos: hidrocefalia, calcificaciones intracraneales, coriorretinitis, retraso mental y epilepsia.
El presente artículo resalta la importancia del diagnóstico temprano para así tratar de manera oportuna según el caso, para reducir los efectos de la infección. Por ello, el control del embarazo debe realizarse a cabalidad, porque dentro de su protocolo de atención se incluyen los exámenes pertinentes para su pronta detección. Si la embarazada llegara a ser diagnosticada, el tratamiento comenzaría dependiendo de la semana de gestación y la situación clínica de la paciente, de los controles rutinarios en busca de anticuerpos IgM, IgG, IgA, y de los resultados de la PCR (Polimerase Chain Reaction) en el líquido amniótico (después de la semana 20 de gestación) en busca de evidencia de infección fetal. Claro está, que no toda la población de algunos países tiene acceso a los exámenes y pruebas especializadas o a disposición, lo que requiere un control ecográfico más asiduo para detectar posibles daños fetales. En algunos países, el aborto está sugerido como tratamiento una vez confirmada la infección toxoplásmica en el feto, porque sus leyes y culturas así lo permiten.
El neonato con toxoplasmosis congénita deberá ser tratado según el protocolo establecido para detener la infección de toxoplasma Gondi. Sin embargo, después del nacimiento, muchas veces las secuelas de la TC no se hacen evidentes sino muchos años después.
Metodología
La recolección de datos e información sobre el presente tema se realizó de forma exhaustiva dada la cantidad de literatura documentada sobre la Toxoplasmosis humana, la cual fue organizada y seleccionada según avances investigativos sobre la enfermedad, actualizaciones sobre diagnóstico y tratamientos vigentes, de manera general y específica sobre el tema de la enfermedad durante el embarazo, y para el niño que presenta la enfermedad congénita.
No sólo se utilizó como herramienta de investigación la Internet, sino que se consultó opiniones expertas de médicos obstetras que estuvieron a disposición, que han tenido suficiente experiencia con la enfermedad y han constatado el tratamiento más adecuado para los casos clínicos que han podido manejar, así como los métodos diagnósticos que han aplicado. De esta manera, se tuvo una visión más top que permitió comparar toda la información para obtener una investigación descriptiva correcta.
Resultados
Toxoplasma gondii
El Toxoplasma Gondii es un parásito protozoario de 4 a 6 mcm de longitud x 2 a 3 mcm de ancho, con extremos redondeados o afilados, que fue descrito entre 1908 y 1909 por Nicolle y Manceaux, cuando hacían estudios paralelos sobre un tipo de roedor conocido como Ctenodactylus Gundi, y se dieron cuenta de que la infección que estos presentaban era adquirida. (Info-Farmacia, 2014).
Durante muchos años no se estableció un consenso en cuanto a su taxonomía zoológica, hasta que en 1964, la Sociedad de Protozoólogos decidió incluirlo en el grupo Phylum Sporozoa. Y no fue sino hasta 1970 que se descubrió su ciclo de vida completo, identificándose la fase sexual del parásito en el intestino delgado del gato.
El T. Gondii tiene una amplia gama de hospedadores, sin embargo, se ha especificado en los felinos como el definitivo. A los gatos se les ha señalado como los responsables de la trasmisión a los humanos, pero en realidad sólo un gato enfermo puede trasmitirla. Además, hoy en día se sabe que el consumo de carnes, el agua, o la mala manipulación de alimentos, son las principales vías para llegar hasta los seres humanos. Aunque convivir con un felino que no recibe atención veterinaria adecuada, probablemente aumente el riesgo de contraer la enfermedad, porque los oocistos infecciosos excretados en sus heces pueden vivir hasta 18 meses en el medio ambiente.
Se han identificado tres cepas parasitarias:
Tipo II se ha identificado principalmente en Europa y América del Norte
Tipo III y recombinante I / III son comunes en Latinoamérica.
Estas últimas resultaron ser muy virulentas porque se han asociado a mayor cantidad de afecciones oculares y toxoplasmosis congénitas que en la mayoría de los países europeos y América del Norte.
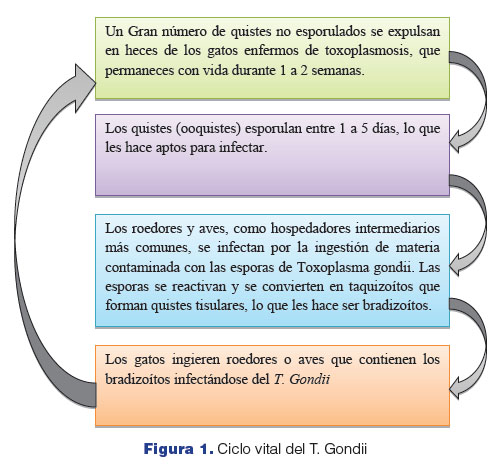
Figura 1. Ciclo vital del T. Gondii
Fuente: Elaboración propia datos de Info-Farmacia, 2014 (ob. cit).
Vías de trasmisión del T. Gondii al ser humano
El ser humano realmente es un hospedero intermediario del T. Gondii, y sus principales formas de adquirir la enfermedad derivan de malos hábitos alimenticios, de higiene o por déficit sanitarios (escases de agua potable, o de agua apta para consumo humano). Basicamente, el ser humano puede contagiarse por:
Trasmisión del útero al feto
La infección de transmisión vertical por (Stray Pedersen & Foulon, 2000) (Aspöck & Pollak, 1992) (Access Medicina, 2020) (National Geographic, 2020)es conocida como toxoplasmosis congénita (TC), se produce por la vía transplacentaria de dicho protozoario al feto, una vez ocurrida la infección materna, con una incidencia de 190100 casos al año, donde “Sudamérica, algunos países de Oriente Medio y países de renta baja presentaron cargas elevadas.” (OMS, 2013)
Algunos estudios indican que la probabilidad de que la madre no tratada contagie al feto vía placentaria en las últimas semanas de gestación, es casi de un 65%, mientras que en las primeras semanas de embarazo la probabilidad es menor. Pero si el contagio se produce en las primeras semanas, el daño fetal llega a ser muchísimo mayor en comparación al contagio producido hacia el final del embarazo. La razón de por qué la probabilidad de contagio es mayor en las últimas semanas de gestación, es porque éste protozoario prefiere infectar un tejido placentario maduro.
Si el contagio se produce:
Cabe señalar que si la madre ya ha padecido la enfermedad, o ha trascurrido la enfermedad sintomáticamente antes del embarazo, no se corre peligro de contagio trasplacentario del feto, salvo que su sistema inmunológico esté afectado por alguna enfermedad subyacente.
Diagnóstico
Aunque los signos clínicos de la Toxoplasmosis son adenopatías, fiebre, malestar general, cefalea, mialgias, odinofagia, eritema máculo papular, hepatomegalia y esplenomegalia, la infección aguda en las embarazadas, generalmente cursa asintomáticamente. Básicamente, durante el embarazo se procura chequear en los controles prenatales mensuales, que la paciente no esté contagiada por este protozoario, y si lo estuviese, entonces se tomarían las medidas diagnóstica para determinar si el feto pudiera llegar a infectarse, y aunque no manifieste la cínica de la enfermedad al nacer (porque pudiera ser que contrajera la enfermedad a mitad del embarazo), se le debe administrar el tratamiento profiláctico, como también debe realizársele las pruebas diagnósticas inmunoglobulinas IgG, IgM, IgA e IgE específicas en sangre, así como la PCR sobre la placenta y sangre del recién nacido o del cordón umblical, para completar el diagnóstico y comprobar el contagio, si es que éste llegó a ocurrir.
Toda paciente, desde su primer control prenatal, debe indicársele los exámenes pertinentes donde se incluyen las pruebas serológicas que nos darán resultados de los anticuerpos del organismo contra el T. Gondii, a partir de los cuales se desarrolla un protocolo para el dianóstico de la TC.
Existen en la actualidad, diferentes métodos para llevar a cabo el diagnóstico de la TC, los cuales se clasifican en:
Indirectos:
Directos:
Salvo en los casos de paciente con VIH/SIDA, normalmente se hacen uso de las pruebas que detectan los antígenos de T. Gondii, de la manera siguiente:
Sin embargo, todas estas pruebas están acompañadas de exámenes de laboratorio y de ecografías, que pueden evidenciar algún daño fetal, de acuerdo a la semana de gestación. Los hallazgos a detectar en los ecos son la dilatación simétrica de los ventrículos, la presencia de zonas hiperecoicas en el parénquima cerebral y menos frecuentemente calcificaciones. También el grosor placentario, ascitis y hepatoesplenomegalia son hallazgos probables cuando la infección se ha producido en el primer trimestre y en menor porcentaje, en los casos de madres con una infección contraída en el segundo trimestre.
De cualquier manera, es de vital importancia tener la certeza de TC para empezar lo antes posible con el tratamiento. Para muchos países, donde el aborto es parte del tratamiento para la TC, es crucial estar seguros de los resultados serológicos, porque un falso positivo podría llegar a ser un error fatal si no se trabaja con prudencia. Po lo que se sugiere el test de avidez de la IgG como técnica que asegura un resultado efectivo y certero.
Por otro lado, el diagnóstico del recién nacido, dependerá de su cuadro clínico y de su serología IgG, IgM e IgA. Las IgG atraviesan la placenta y el título obtenido al momento del nacimiento, coincide con el materno. Los Títulos de IgG elevados, la presencia de IgM y/o IgA, que no atraviesan la placenta, es indicio de infección prenatal. Para la detección de IgM e IgA las técnicas de inmunocaptura son las más indicadas por su sensibilidad y especificidad. Se precisa la determinación de IgM e IgA porque en algunos niños infectados solo se detecta una de estas. Por eso la técnica de ISAGA es la más indicada, ya que para la detección de IgM tiene una sensibilidad del 80% y para IgA del 83%. No obstante, hasta que la IgG de origen materno, se haga negativa, al recién nacido no se le puede considerar libre de la infección por T.Gondii.
Por supuesto, la experiencia y la calidad profesional del especialista tratante, tanto para la madre como para el neonato, juega un papel importante a la hora de un diagnóstico oportuno, porque además conoce a su paciente, y puede sugerir empezar o no un tratamiento en el tiempo justo, y determinar la necesidad de realizar o no alguna prueba más complicada como la PCR.
Tratamiento
Cada país, cada población del mundo tiene sus leyes y culturas, así como sus recursos económicos, que repercuten en las políticas de salud para tratar problemas como la Toxoplamosis Congénita. Pero todos están de acuerdo que es imprescindible aplicar cuanto antes el tratamiento una vez confirmada la enfermedad, porque este garantiza una disminución de las secuelas fetales en por lo menos, un 25% o más.
También es casi un consenso internacional el uso de los siguientes fármacos que han servido para tratar la TC de forma eficaz:
Pirimetamina: Este antiparasitario se usa junto a la sulfadiazina para reducir las formas grave de la enfermedad hasta llevarlo a formas leves y subclínicas. Se debe controlar con hemograma dos veces por semana. Debe suministrarse ácido fólico por vía oral o intramuscular para evitar su efecto tóxico.
Sulfadiazina: Es un antibiótico de tipo sulfamida, bacteriostático, interfiere en la biosíntesis bacteriana de ácido folínico.
Espiramicina: Es un antibiótico macrólido utilizado principalmente para la prevención de la toxoplasmosis congénita durante el primer trimestre del embarazo. Es altamente efectiva contra el T. gondii ,y si bien “sus niveles en sangre del cordón sólo alcanzan el 50% de los niveles séricos maternos, se concentra de manera importante en la placenta, alcanzando niveles de hasta cuatro veces los niveles séricos maternos” (Martín Hernández, 2004). Es una droga de mínima toxicidad y sin efectos teratógenos, es el fármaco adecuado para el tratamiento de la toxoplasmosis durante el embarazo.
Clindamicina/Azitromicina: Pueden usarse para sustituir la Sulfadiazina en caso de intolerancia de la misma.
Ácido Folínico: Es la forma reducida del ácido fólico sirve para reducir efectos tóxicos de la pirimetamina.
Básicamente, el tratamiento tiene como objetivo evitar que el T. Gondii logre entrar en el feto, y si así ha ocurrido, entonces el recién nacido debe recibir el tratamiento adecuado para mitigar algún daño colateral evitando que la enfermedad siga avanzando.
Cada médico tratante establece su esquema de tratamiento según el cuadro clínico de su paciente, pero se propone el siguiente, como un estándar seguido en muchos países:
Infección congénita confirmada en el embarazo
Primer trimestre: 3g de Espiramicina, en 3 tomas al día. No se debe utilizar pirimetamina en el primer trimestre.
Segundo y tercer trimestre: Iniciar tratamiento antiparasitario con la asociación de Pirimetamina , 25 a 50 mg/día, en 1 ó 2 tomas al día; más sulfadiazina hasta el final del embarazo o alternarse con Espiramicina, para reducir la toxicidad.
Recién nacidos con TC
La idea es detener el avance de la enfermedad hasta que el sistema inmune del niño pueda controlarla y eliminarla.
Pirimetamina 1 mg/kg/día por 3 días, seguido de 1 mg/kg cada 2 días, más 100 mg/kg/día en dos dosis de sulfadiazina más5 mg ácido fólico vía oral, dos veces por semana.
La duración del tratamiento está sujeta al criterio médico, pero por lo general es de seis meses a un año. En los casos asintomáticos, normalmente se procede a realizar exámenes, pruebas serológicas y estudios complementarios, para confirmar un avance de la enfermedad o la superación de la misma. El tratamiento profiláctico es lo que médico especialista generalmente aconseja.
Estos tratamientos han dado buenos resultados en muchos países logrando mitigar los daños neurológicos, oftalmológico, y otras secuelas si el mismo se realiza durante y después del embarazo.
Conclusión
Diagnosticar y tratar la toxoplasmosis congénita tempranamente no resulta fácil ya que durante el embarazo la enfermedad transcurre subclínicamente, e inclusive al nacer, los casos asintomáticos de recién nacidos no dejan ver ni las secuelas que a futuro puedan manifestarse, y las técnicas de detección como ISAGA, no siempre están disponibles ni a la disposición de los pacientes.
El médico especialista aplica los protocolos de atención para determinar en cada consulta, que la gestante esté libre de esta infección, es decir, la paciente presenta pruebas IgG negativa e IgM negativa. Cuando este es el caso, se le debe orientar sobre los riesgos de esta enfermedad, indicándoles las precauciones pertinentes para evitar contagiarse con T.Gondii. En estos casos, las pruebas continúan como control esperando que el embarazo trascurra sin ningún problema hasta su feliz término. Esto es mucho más válido para las pacientes cuyas serologías IgG positiva e IgM negativa, ya que no tiene que preocuparse, ni preocupar a su médico, de contraer la enfermedad, porque obviamente ya estuvo expuesta hace mucho tiempo.
No obstante, cuando las pruebas IgG Negativa e IgM positiva, o IgG Positiva e IgM positiva, la sospecha de haber contraído la enfermedad es muy alta, por lo que se requieren hacer todas las pruebas diagnósticas pertinentes, que conjuntamente con los exámenes rutinarios y la ecografía, se va dilucidando y definiendo el diagnóstico que ninguna madre quiere oír, si conociera a cabalidad la gravedad de la Toxoplasmosis Congénita. En el mejor de los pronósticos, prematuridad y bajo peso al nacer, pero la probabilidad que el feto sea contagiado, es muy alta, y si además el contagio ocurre en las primeras semanas de gestación, no hay un buen pronóstico fetal.
La gestante con toxoplasmosis debe someterse al tratamiento estipulado, con la esperanza de detener el avance de la enfermedad y no logre llegar al feto. Una vez logrado el parto, el neonato debe ser examinado y avaluado para detectar posibles secuelas, pero sintomático o no, se recomienda realizar tratamiento profiláctico por seis meses o un año, según el caso, ya que la Toxoplasmosis Congénita puede mantenerse asintomática toda la vida o puede reactivarse de manera impredecible.
REFERENCIAS BIBLIOGRÁFICAS
ABC. (21 de Junio de 2017). Científicos hallan la manera de acabar con el parásito de la toxoplasmosis. Obtenido de https://www.abc.es/salud/enfermedades/abci-cientificos-hallan-manera-acabar-parasito-toxoplasmosis-201706210915_noticia.html?ref=https%3A%2F%2Fwww.google.com%2F
Access Medicina. (10 de 07 de 2020). Ácido Folínico: Antidoto. Obtenido de https://accessmedicina.mhmedical.com/content.aspx?bookid=1552§ionid=90366758
Aspöck , H., & Pollak, A. (1992). Prevention of Prenatal Toxoplasmosis by Serological Screening of Pregnant Woman in Austria. Scand J Infect Dis, 32-37.
Bodaghi, B., Touitou, V., Fardeau, C., Paris, L., & LeHoang, P. (2012). Toxoplasmosis: new challenges for an old disease. Eye, 26, 241-244.
Flegr, J., Prandota, J., & Israili, Z. H. (2014). Toxoplasmosis – A Global Threat. Correlation of Latent Toxoplasmosis with Specific Disease Burden in a Set of 88 Countries. Plos One, Online.
Info-Farmacia. (11 de Septiembre de 2014). Microbiología y Parasitología. Obtenido de Toxoplasma Gondii: http://www.info-farmacia.com/microbiologia/toxoplasma-gondii
Martín Hernández, I. (2004). Toxoplasmosis congénita: una. Biomédica, 15, 181-190.
National Geographic. (1 de 05 de 2020). Descubre Nat Geo. Obtenido de Toxoplasmosis, nuevos descubrimientos: https://www.nationalgeographic.es/ciencia/toxoplasmosis-nuevos-descubrimientos
OMS. (2013). The global burden of congenital toxoplasmosis: a systematic review. Bull World Health Organ, 91, 501-508.
Remington, J. S., & J O, K. (2001). Infectious diseases of the fetus and newborn. Philadelphia: WB Saunders.
Stray Pedersen, B., & Foulon, W. (2000). Effect of treatment of the infected pregnant woman and her foetus. In: Ambroise-Thomas P & Petersen E (Eds) Congenital toxoplasmosis. Scientific Background, Clinical Management and Control. France, 141-152.