

DOI: 10.26820/recimundo/4.(4).octubre.2020.261-269
URL: http://recimundo.com/index.php/es/article/view/897
EDITORIAL: Saberes del Conocimiento
Revista: RECIMUNDO
ISSN: 2588-073X
Tipo de Investigación: Artículo de Revisión
Código UNESCO: Ciencias Médicas
Paginas: 261-269

Jessenia Paola Ochoa Bustamante1; Silvio Eleuterio Ortiz Dueñas2; Gilda Priscila Chuya Bacusoy3
 https://orcid.org/0000-0003-2069-0371
https://orcid.org/0000-0003-2069-0371 https://orcid.org/0000-0001-8080-2748
https://orcid.org/0000-0001-8080-2748 https://orcid.org/0000-0002-0788-5679
https://orcid.org/0000-0002-0788-5679CORRESPONDENCIA
Jessenia Paola Ochoa Bustamante
pao_ochoab@hotmail.com
Guayaquil; Ecuador
terísticas de presentación comunes tanto en entornos de atención primaria como secundaria. Estos síntomas pueden ser causados por una serie de afecciones diferentes, incluida la enfermedad inflamatoria intestinal (EII), de las cuales la colitis ulcerosa (CU) y la enfermedad de Crohn (EC) son las más comunes, al igual que el síndrome del intestino irritable (SII). La incidencia estimada de la enfermedad en países occidentalizados es de 5 por cada 100000 personas, en Sudamérica la incidencia estimada es del 0 a 3,5 por cada 100000 habitantes, mientas que su prevalencia es del 0,9 al 41,4 por cada 100000 personas. La metodología de la investigación es una revisión bibliográfica, apoyada en medios electrónicos, como fuente primaria de obtención de información. Entre la conclusión más relevante es que la calprotectina fecal es un excelente marcador para detectar la enfermedad inflamatoria intestinal (EII), por su alta sensibilidad y especificidad, incluso para diferenciarla del síndrome de intestino irritable (SII). A su vez la realización de la muestra y test para determinar la calprotectina fecal es económica, y donde el más utilizado es el ELISA; a su vez el biomarcador CF es una herramienta también de detección útil para la identificación pacientes que requieren colonoscopia por sospecha de EII.
Palabras claves: Biomarcadores, ELISA, Intestinal, Calprotectina, Fecal.
Lower gut symptoms, including chronic abdominal pain or discomfort with diarrhea or constipation, are common presenting features in both primary and secondary care settings. These symptoms can be caused by a number of different conditions, including inflammatory bowel disease (IBD), of which ulcerative colitis (UC) and Crohn's disease (CD) are the most common, as is bowel syndrome. Irritable (IBS). The estimated incidence of the disease in Westernized countries is 5 per 100,000 people, in South America the estimated incidence is 0 to 3.5 per 100,000 inhabitants, while its prevalence is 0.9 to 41.4 per 100,000 people. The research methodology is a bibliographic review, supported by electronic media, as the primary source of obtaining information. Among the most relevant conclusion is that fecal calprotectin is an excellent marker to detect inflammatory bowel disease (IBD), due to its high sensitivity and specificity, even to differentiate it from irritable bowel syndrome (IBS). In turn, the performance of the sample and test to determine fecal calprotectin is economical, and where the most used is the ELISA; in turn, the CF biomarker is also a useful screening tool for the identification of patients who require colonoscopy for suspected IBD.
Keywords: Biomarkers, ELISA, Intestinal, Calprotectin, Fecal.
Sintomas do intestino grosso, incluindo dor abdominal crônica ou desconforto com diarreia ou constipação, são características de apresentação comuns em ambientes de cuidados primários e secundários. Esses sintomas podem ser causados por uma série de condições diferentes, incluindo a doença inflamatória intestinal (DII), das quais a colite ulcerativa (UC) e a doença de Crohn (CD) são as mais comuns, assim como a síndrome intestinal. Irritável (IBS). A incidência estimada da doença nos países ocidentais é de 5 por 100.000 habitantes, na América do Sul a incidência estimada é de 0 a 3,5 por 100.000 habitantes, enquanto sua prevalência é de 0,9 a 41,4 por 100.000 habitantes. A metodologia da pesquisa é uma revisão bibliográfica, apoiada em meio eletrônico, como principal fonte de obtenção de informações. Entre as conclusões mais relevantes está que a calprotectina fecal é um excelente marcador para detectar doença inflamatória intestinal (DII), devido a sua alta sensibilidade e especificidade, até mesmo para diferenciá-la da síndrome do intestino irritável (SII). Por sua vez, a realização da amostra e do teste para determinação da calprotectina fecal é econômica, sendo que o mais utilizado é o ELISA; por sua vez, o biomarcador de FC também é uma ferramenta de triagem útil para a identificação de pacientes que precisam de colonoscopia por suspeita de DII.
Palavras-chave: Biomarcadores, ELISA, Intestinal, Calprotectina, Fecal.
INTRODUCCIÓN
El dolor abdominal funcional es una causa frecuente de asistencia en las consultas de atención primaria y de gastroenterología, requiriendo incluso en algunas ocasiones ingresos hospitalarios. El principal reto es diferenciarlo de una patología orgánica que a veces puede conllevar la realización de múltiples pruebas diagnósticas con los riesgos que estas pueden acarrear, sus efectos secundarios y las pérdidas de horas escolares para los pacientes pediátricos y laborales para los padres (Bonnin Tomás, Vila Vidal, & Rosell Camps, 2007).
Los síntomas del intestino inferior, que incluyen dolor abdominal crónico o malestar con diarrea o estreñimiento, son características de presentación comunes tanto en entornos de atención primaria como secundaria. Estos síntomas pueden ser causados por una serie de afecciones diferentes, incluida la enfermedad inflamatoria intestinal (EII), de las cuales la colitis ulcerosa (CU) y la enfermedad de Crohn (EC) son las más comunes, al igual que el síndrome del intestino irritable (SII) (Hallo, Caiza, Pineda, & Gil, 2020).
La incidencia estimada de la enfermedad en países occidentalizados es de 5 por cada 100000 personas, en Sudamérica la incidencia estimada es del 0 a 3,5 por cada 100000 habitantes, mientas que su prevalencia es del 0,9 al 41,4 por cada 100000 personas (Fierro Castillo, 2020).
Tabla 1. Factores de riesgo de la EII
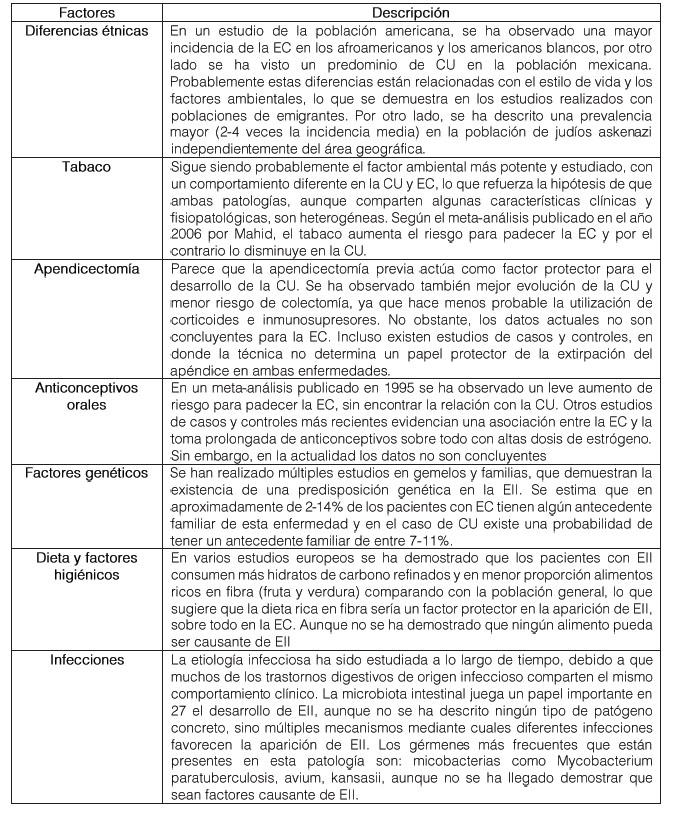
Fuente: (Gajownik, 2018). Elaboración Propia.
La etiología de la EII es desconocida, aunque basándose en la evidencia clínica y experimental, sugiere que la aparición de la misma parece ser un resultado de la mezcla de factores genéticos, inmunológicos y ambientales. No existe una sola causa que explique el desarrollo de estas entidades. Genéticamente existe una mayor prevalencia entre familiares, que en la población general, esto parece sugerir que existe cierta predisposición genética, unida a otros determinantes ambientales, tipo de flora intestinal y de respuesta inmune anómala, que pueden en su conjunto desencadenar la EII (Gajownik, 2018).
Existe una serie de marcadores fecales que permiten evaluar inflamación intestinal de manera simple, no invasiva y reproducible, de estos, la calprotectina fecal (CF) es la más utilizada, siendo una prueba fácil de realizar, económica y aceptada por los pacientes (Covarrubias R, Madrid S, Rojas B, & Gompertz G, 2018). En este contexto Morón, Arias, & Manrique (2017), comentan que la CF ha demostrado tener una gran precisión en el diagnóstico de la EII, detectar actividad inflamatoria en enfermedad de Crohn (EC) y CU, utilidad como marcador pronóstico de evolución en los pacientes que alcanzan remisión clínica, utilidad como marcador pronóstico de recurrencia postquirúrgica previo al inicio de los síntomas y útil para monitorizar la respuesta al tratamiento con anti-TNFα ayudándonos a establecer que pacientes alcanzan la curación mucosa.
La calprotectina es una proteína que se encuentra en el organismo de forma abundante y ampliamente distribuida. Es un heterodímero de unión a calcio y zinc de 36.5 kDa que pertenece a la familia S100. Se encuentra principalmente en los gránulos de neutrófilos polimorfonucleares (PMNs) donde representa el 5% de las proteínas totales y 60% de las proteínas citosólicas. También está presente, aunque en menor proporción, en monocitos, macrófagos reactivos y células epiteliales. Se ha demostrado que la calprotectina presenta propiedades bacteriostáticas y fungicidas y su síntesis aumenta durante el proceso inflamatorio, en donde los niveles plasmáticos se elevan entre 5 y 40 veces. También se encuentra presente en las heces y la concentración de CF es hasta 6 veces superior a los niveles plasmáticos (Covarrubias R, Madrid S, Rojas B, & Gompertz G, 2018).
Metodología
La metodología de la investigación, es una revisión bibliográfica apoyada en medios electrónicos como fuente primaria de la obtención de la información. Se han encontrado un sinnúmero de investigaciones que abordan la vinculación que hay entre la enfermedad inflamatoria intestinal (EII) y la calprotectina fecal (CF).
Resultados
El valor de la CF para discriminar síntomas digestivos funcionales y orgánicos ha sido analizado en numerosos estudios. Un metaanálisis que incluyó 2.475 pacientes determinó la sensibilidad y la especificidad para diferenciar enfermedad orgánica de funcional, siendo estas del 83 y del 84%, respectivamente39. El principal inconveniente de la CF en este contexto es su baja precisión para detectar cáncer colorrectal (CCR). Por este motivo, en una población de estudio en riesgo de CCR (p.ej., paciente de > 50 anos ˜ o con antecedentes familiares de CCR) la CF no será el test más adecuado. En cambio, en un con texto de bajo riesgo de CCR (p.ej., población de menos de 50 años). La CF puede resultar una herramienta muy valiosa para diferenciar una EII del síndrome de intestino irritable (Guardiola, Lobatón, Cerrillo, & Ferreiro-Iglesias, 2018).
De este modo, podemos considerar la CF como un test adecuado para identificar aquellos pacientes sintomáticos que muy probablemente presentan enfermedad orgánica y que por tanto precisan exploraciones adicionales, especialmente en población de bajo riesgo de CCR. Esto podría ser especialmente útil en el ámbito de atención primaria como método de cribado para decidir la idoneidad de colonoscopia o de derivación al especialista (Guardiola, Lobatón, Cerrillo, & Ferreiro-Iglesias, 2018).
Los marcadores fecales parecen ser prometedores y más específicos para detectar la presencia de inflamación intestinal en pacientes con EII establecida. Se han observado resultados prometedores con el empleo de la calprotectina fecal (CPF), tanto en pacientes con EC como con CU. Datos recientes sugieren sin embargo, que la eficacia de la CPF, al contrario que la PCR, presenta una mayor sensibilidad diagnóstica en pacientes con CU, que con EC (Rodrigo, 2007).
A este respecto la CPF es un marcador que refleja la presencia y el grado de inflamación intestinal. Su determinación ha demostrado una clara utilidad para ayudar a la realización del diagnóstico diferencial y en el seguimiento de pacientes, si bien su valor diagnóstico discriminativo no llega a alcanzar una potencia suficiente para poder separarlos en todos los casos. Se obtiene un mayor valor discriminativo en la separación entre enfermedades inflamatorias y funcionales cuando el valor umbral de la CPF se eleva a 100 µg/g, como han confirmado recientemente algunos autores (Rodrigo, 2007).
La distinción entre enfermedad intestinal funcional y orgánica mediante CF ha sido objeto de varios estudios. Menees y cols. Encontraron que pacientes con CF ≤ 40 μg/g tienen una probabilidad ≤1% de padecer EII. Un metaanálisis que evaluó la precisión diagnóstica de CF en EII reportó una sensibilidad de 0,95, especificidad de 0,91 y AUC de 0,95 para el diagnóstico de EII, con mayor precisión diagnóstica para un punto de corte de 100 μg/g que 50 μg/g. El retardo en el diagnóstico por un falso negativo ocurrió entre 6 y 8% de los pacientes (Pérez de Arce, Sedano, & Quera, 2020).
Recientemente, se ha sugerido el uso de CF en el estudio de pacientes con diarrea crónica con un valor de corte de 50 μg/g para optimizar la sensibilidad para EII. Por otra parte, otros señalan tres rangos de CF para la orientación diagnóstica: pacientes con CF > 250 μg/g se beneficiarán de un estudio endoscópico precoz; valores intermedios (100-250 μg/g) deberán ser interpretados con precaución, considerando repetir el test y, junto a una historia clínica compatible, decidir qué pacientes necesitarán estudio endoscópico; CF < 100 μg/g no requerirán un estudio invasivo inmediato, debiéndose plantear diagnósticos diferenciales no inflamatorios. Puntos de corte más bajos aumentan la sensibilidad del test para EII, sin embargo, también aumenta el número de colonoscopias innecesarias por falsos positivos. Puntos de corte más altos aumentarán la especificidad, pero también la proporción de pacientes no diagnosticados (Pérez de Arce, Sedano, & Quera, 2020).
La toma de muestras fecales puede realizarse indistintamente en la mañana o en la tarde y conservarse hasta 3 días a temperatura ambiente, y no se recomienda después de la preparación para una colonoscopía o toma de biopsias. Puede medirse por técnica de ELISA (ensayo por inmunoabsorción ligado a enzimas), que permite una medición cuantitativa (la más recomendada), o por ensayos de detección rápida (inmunocromatografía), que entregan resultados semicuantitativos o cualitativos (Pérez de Arce, Sedano, & Quera, 2020).
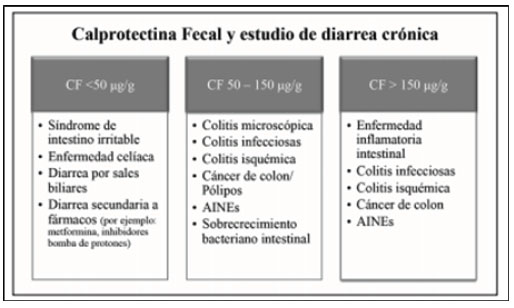
Imagen 1. Orientación diagnóstica según valores de calprotectina fecal (CF) durante el estudio de diarrea crónica
Fuente: (Pérez de Arce, Sedano, & Quera, 2020).
Utilidad de la calprotectina fecal en EII
Diagnóstico diferencial
Las manifestaciones de la EII no son específicas y tampoco existe un signo o síntoma patognomónico, por lo que en todos los pacientes con dolor abdominal y diarrea crónica recurrente debería plantearse el diagnóstico de EII. Sin embargo, muchos de los pacientes que tienen estos síntomas tienen una endoscopia negativa para lesiones mucosas, por lo que es importante distinguir que pacientes se beneficiarían de la realización de endoscopia y cuales sufren patología funcional. El diagnóstico del síndrome de intestino irritable (SII) basado en los criterios de Roma podría ser erróneo, ya que casi 1/3 de pacientes con EII cumplen los criterios de Roma para SII (Gajownik, 2018).
Diagnóstico de EII
Se ha visto que los niveles de la calprotectina fecal están constantemente más elevados en pacientes con EII comparando pacientes con SII o controles sanos. En la imagen 2 están incluidos los resultados de los estudios más importantes para investigación de la CPF en pacientes con EII. Tibble et al., han validado por primera vez la CPF como marcador de la inflamación intestinal comparando su niveles con la excreción de leucocitos marcados con indio 111 (Gajownik, 2018).
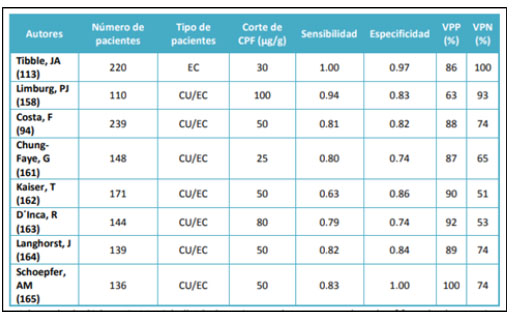
Imagen 2. Precisión diagnóstica de la CPF en EII
Fuente: (Gajownik, 2018).
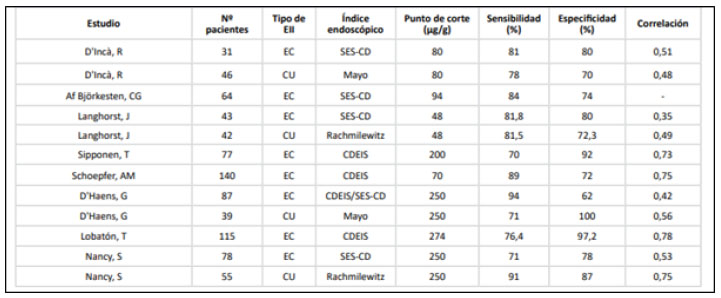
Imagen 3. Precisión diagnóstica y correlación entre CF y actividad endoscópica en EII
Fuente: (Morón, Arias, & Manrique, 2017)
Varios estudios han analizado la precisión diagnóstica de CF para detectar la presencia de actividad inflamatoria en pacientes con EII (Imagen 3). Observan que existe una buena correlación positiva entre los niveles de CF y los índices endoscópicos (CDEIS y SES-CD para EC; Mayo y Rachmilewitz para CU). Además, en estos estudios se han estimado puntos de corte de CF, con la mayor sensibilidad y especificidad posible, con el objetivo de calcular la probabilidad de presentar actividad endoscópica (Morón, Arias, & Manrique, 2017).
La identificación de la actividad inflamatoria es fundamental en los pacientes con EII. La evaluación de los síntomas clínicos no ha demostrado ser una herramienta útil para detectar de forma precisa la presencia de inflamación a nivel intestinal a pesar de la existencia de instrumentos específicos como el Crohn’s Disease Activity Index (CDAI). Se ha observado que hasta en el 70% de los pacientes que alcanzan la remisión clínica pueden presentar algún grado de actividad inflamatoria detectado en la colonoscopia (Morón, Arias, & Manrique, 2017).
El curso natural de la EII es impredecible, aunque típicamente se caracteriza por presentar períodos de remisión que se alternan con períodos de recidiva clínica en los que se exacerba la inflamación intestinal. También puede aparecer una evolución con cursos distintos como sería presentar una remisión prolongada tras el primer brote de actividad, tener una actividad leve durante los primeros años con un aumento de la gravedad posteriormente o presentar actividad clínica de forma crónica a pesar de los tratamientos instaurados (Morón, Arias, & Manrique, 2017).
Un elevado número de pacientes con EII en remisión clínica presentan algún grado de inflamación residual en la mucosa intestinal. Estos pacientes se pueden detectar observando que presentan niveles elevados de CF a pesar de estar en remisión clínica. Varios estudios han demostrado que la concentración de CF puede predecir la recaída en pacientes con EII en remisión clínica en un plazo de 12 meses. Ya en el año 2000, Tibble et al realizaron un estudio con 80 pacientes (43 EC y 37 CU) en remisión. Observaron que la CF podía predecir la recidiva con una sensibilidad del 90% y una especificidad del 83% (Morón, Arias, & Manrique, 2017).
Conclusiones
Como se ha podido afirmar por la investigación aquí realizada, la calprotectina fecal es un excelente marcador para detectar la enfermedad inflamatoria intestinal (EII), por su alta sensibilidad y especificidad, incluso para diferenciarla del síndrome de intestino irritable (SII). A su vez la realización de la muestra y test para determinar la calprotectina fecal es económica, y donde el más utilizado es el ELISA; a su vez el biomarcador CF es una herramienta también de detección útil para la identificación pacientes que requieren colonoscopia por sospecha de EII.
Sin embargo una de las limitaciones que tiene el biomarcador CF es que no están definidos claramente los puntos de cortes óptimos para sus diferentes utilidades. La sensibilidad y especificidad de la prueba varía según el punto de corte que se determine en función de lo que se quiera conseguir.
Si se comparan métodos de medición de la CF para la predicción de la actividad endoscópica, el método Bühlmann, tiene mejores resultados que el EliaTM.
La CF es ideal en la actividad clínica por tener buena afinidad con los índices clínicos de Mayo para la Colitis Ulcerosa y CDAI para la Enfermedad de Crohn producida por la EII.
REFERENCIAS BIBLIOGRÁFICAS
Bonnin Tomás, A., Vila Vidal, M., & Rosell Camps, A. (2007). Calprotectina fecal como marcador diferencial entre patología gastrointestinal orgánica y funcional. Revista española de enfermedades digestivas, 99(12), 689-693. Obtenido de http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1130-01082007001200002&lng=es&nrm=iso
Covarrubias R, N., Madrid S, A., Rojas B, R., & Gompertz G, M. (2018). Calprotectina fecal: utilidad en el diagnóstico diferencial de enfermedad inflamatoria intestinal y síndrome intestino irritable en adultos. Rev. Hosp. Clin. Univ. Chile, 29(2), 166-172.
Fierro Castillo, V. D. (2020). Relación del valor de calprotectina fecal con el estado de actividad de la enfermedad en los pacientes con Enfermedad Inflamatoria Intestinal atendidos en el Hospital Carlos Andrade Marín y en el Hospital de Especialidades Fuerzas Armadas N° 1 de la ciuda. Quito: PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR. Obtenido de http://repositorio.puce.edu.ec/handle/22000/17510
Gajownik, U. E. (2018). Evaluación de al calprotectina fecal en la detección de la actividad de la enfermedad inflamatoria intestinal del colon. Proyecto de investigación. Murcia: Universidad de Murcia. Obtenido de http://hdl.handle.net/10201/56358
Guardiola, J., Lobatón, T., Cerrillo, E., & Ferreiro-Iglesias, R. (2018). Recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) sobre la utilidad de la determinación de calprotectina fecal en la enfermedad inflamatoria intestinal. Gastroenterología y Hepatología, 41(8), 514-529. doi: https://doi.org/10.1016/j.gastrohep.2018.05.029
Hallo, D. R., Caiza, J., Pineda, L., & Gil, E. (2020). Calprotectina fecal como marcador para enfermedad inflamatoria intestinal. RECIMUNDO, 4(4), 152-160. doi: https://doi.org/10.26820/recimundo/4.(4).octubre.2020.152-160
Morón, J. M., Arias, F., & Manrique, H. (2017). Utilidad de la calprotectina fecal en la enfermedad inflamatoria intestinal. Revista andaluza de patología digestiva, 40(2), 70-78.
Pérez de Arce, E., Sedano, R., & Quera, R. (2020). Biomarcadores en enfermedad inflamatoria intestinal:¿ sabe cómo utilizarlos? Revista médica de Chile, 148(3), 362-370. doi: http://dx.doi.org/10.4067/S0034-98872020000300362
Rodrigo, L. (2007). Calprotectina fecal. Revista Española de Enfermedades Digestivas, 99(12), 683-688.